题目内容
【题目】反应N2O4(g) ![]() 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
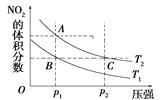
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. A、B两点气体的平均相对分子质量:A>B
D. B、C两点化学平衡常数:B<C
【答案】D
【解析】A、A、C两点温度相同,C点压强大于A点,所以C点反应速率大于A点反应速率,A错误;B、C点压强大于A点压强,所以C点容器体积小于A 点容器体积,所以C点NO2的浓度大于A点NO2的浓度,C点颜色深,A点浅,B错误;C、A、B两点压强相同,B点到A点NO2体积分数增大,平衡正向移动,气体的总物质的量增大,又由于气体的总质量不变,所以混合气体的平均相对分子质量减小,即A、B两点气体的平均相对分子质量:B > A,C错误;D、A、B两点压强相同,B点到A点NO2体积分数增大,平衡正向移动,所以B点的平衡常数小于A点的平衡常数,A、C两点温度相同,A、C两点平衡常数相同,所以B点的平衡常数小于C点的平衡常数,D正确。正确答案为D。

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目



