题目内容
【题目】常温下,2.0×10﹣3molL﹣1氢氟酸的水溶液中,调节溶液pH(忽略溶液体积变化)得到的[HF]、[F﹣]与溶液pH的变化关系如下图.下列叙述不正确的是( ) (提示:Ka(CH3COOH)=1.8×10﹣5molL﹣1 , Ksp(CaF2)=1.5×10﹣10mol3L﹣3)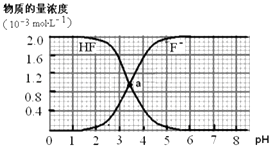
A.两条曲线交点a对应溶液的[F﹣]=[HF]
B.加入NaOH溶液至pH=7,溶液中[F﹣]=[Na+]
C.常温下HF的电离常数Ka(HF)>Ka(CH3COOH)
D.pH=4时,加入CaCl2固体使[Ca2+]=2.0×10﹣3molL﹣1 , 无CaF2沉淀析出
【答案】D
【解析】解:A、纵轴是微粒浓度,横轴是溶液PH,两条曲线交点a对应溶液的[F﹣]=[HF],故A正确; B、加入NaOH溶液反应HF+NaOH=NaF+H2O;溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH﹣)+c(F﹣),至pH=7,c(H+)=c(OH﹣),溶液中[F﹣]=[Na+],故B正确;
C、Ka= ![]() ;当c(F﹣)=C(HF)时,Ka=c(H+)=10﹣3.5=3.5×10﹣4molL﹣1>Ka(CH3COOH)=1.8×10﹣5molL﹣1 , 常温下HF的电离常数Ka(HF)>Ka(CH3COOH),故C正确;
;当c(F﹣)=C(HF)时,Ka=c(H+)=10﹣3.5=3.5×10﹣4molL﹣1>Ka(CH3COOH)=1.8×10﹣5molL﹣1 , 常温下HF的电离常数Ka(HF)>Ka(CH3COOH),故C正确;
D、分析图象当PH=4.0,溶液中的F﹣离子浓度1.6×10﹣3mol;加入CaCl2固体使c(Ca2+)=2.0×10﹣3molL﹣1 , c(Ca2+)×c2(F﹣)=2.0×10﹣3molL﹣1×(1.6×10﹣3)2=5.1×10﹣10>Ksp(CaF2),有沉淀生成,故D错误;
故选D.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案
相关题目