题目内容
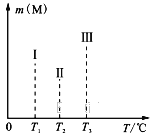
【题目】25℃时在10mL 0.1molL﹣1Na2CO3溶液中逐滴加入0.1molL﹣1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( ) 
A.Na2CO3溶液中c(Na+)═2[c(CO32﹣)+c(HCO3﹣)+c(H2CO3)]
B.a、b曲线分别代表的是HCO3﹣、H2CO3量的变化情况
C.A点时:c(Na+)>c(CO32﹣)═c(HCO3﹣)>c(H+)>c(OH﹣)
D.B点时加入盐酸的体积为10mL,两者恰好完全反应生成NaHCO3
【答案】C
【解析】解:A.Na2CO3溶液中存在物料守恒,即Na元素的总物质的量等于C元素总物质的量的2倍,则c(Na+)═2[c(CO32﹣)+c(HCO3﹣)+c(H2CO3)],故A正确; B.Na2CO3溶液中逐滴加入HCl先发生反应CO32﹣+H+=HCO3﹣ , 然后发生HCO3﹣+H+=H2CO3 , 由图象可知a代表的物质逐渐增多,则aHCO3﹣ , b代表的物质开始没有,后来逐渐增多,则b为H2CO3 , 故B正确;
C.由图象可知,A点时:c(CO32﹣)和c(HCO3﹣)相同,溶液显碱性,则c(Na+)>c(CO32﹣)═c(HCO3﹣)>c(OH﹣)>c(H+),故C错误;
D.B点时加入盐酸的体积为10mL,则Na2CO3和HCl的物质的量相同,由CO32﹣+H+=HCO3﹣可知,二者恰好反应生成NaHCO3 , 故D正确.
故选C.

【题目】(10分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

按下列合成步骤回答问题:
苯 | 溴 | 溴苯 | |
密度/g·cm—3 | 0.88 | 3.10 | 1.50 |
沸点℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)写出a中生成溴苯的化学方程式 ;
(2)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了__________气体,继续滴加至液溴滴完。装置d装置的作用是 。
(3)液溴滴完后,经过下列步骤分离提纯: ①向a中加入10 mL水,然后过滤除去未反应的铁屑; ②滤液依次用l0 mL水、8 mL l0%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是 ;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是 。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为__ ;要进一步提纯,下列操作中必须的是______(填入正确选项前的字母)。
A. 重结晶 B. 过滤 C. 萃取 D. 蒸馏
【题目】如表是周期表中的一部分,根据A﹣K在周期表中的位置,用元素符号或化学式回答.
族 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H | ||||
4 | J | K |
(1)表中元素,化学性质最不活泼的是 , 只有负价而无正价的是 , 氧化性最强的单质是 , 还原性最强的单质是 .
(2)最高价氧化物的水化物碱性最强的是 , 酸性最强的是 , 呈两性的是 .
(3)A分别与D,E,F,G,H形成的化合物中,最稳定的 ,
(4)在这些元素中(除I外),原子半径最大的是 , 原子半径最小的是
(5)D和K组成化合物的电子式 ,
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式: .