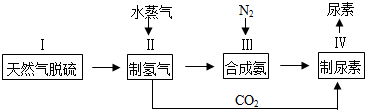
题目内容
6.下列有关实验的说法正确的是( )| A. | 分液时,分液漏斗中的上层液体应由上口倒出 | |
| B. | 为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测定 | |
| C. | 制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 | |
| D. | 欲配制质量分数为10%的ZnSO4溶液,将l0 g ZnSO4•7H2O溶解在90 g水中 |
分析 A.分液操作时下层液体从下口放出,上层液体从上口倒出;
B.瓷坩埚中含有二氧化硅,在加热条件下能与氢氧化钠反应;
C.制备Fe(OH)3胶体通常的做法是在沸水中滴加饱和的氯化铁溶液;
D.溶质ZnSO4的质量小于10g.
解答 解:A.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,避免两种液体相互污染,故A正确;
B.瓷坩埚中含有二氧化硅,在加热条件下能与氢氧化钠反应而导致坩埚炸裂,故B错误;
C.制备Fe(OH)3胶体通常的做法是在沸水中滴加饱和的氯化铁溶液,至溶液呈红褐色时停止加热,故C错误;
D.溶液的质量为100g,而溶质ZnSO4的质量小于10g,故D错误.
故选A.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.

练习册系列答案
相关题目
16.烷烃C6H14的同分异构体数目是( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
14.为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20°C)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如下:
注:经检验黑色固体为Ag
①白色沉淀的化学式是Ag2SO4.
②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.

b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
①实验Ⅲ不能(填“能”或“不能”)证明Fe3+氧化了Ag,理由是因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag.
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
已知:相关物质的溶解度(20°C)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如下:
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3溶液加入到 1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
①白色沉淀的化学式是Ag2SO4.
②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.

b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
18.自第十一届奥运会以来,开幕式都要举行隆重的火炬接力仪式.火炬的可燃物是丁烷 (化学式为 C4H10),它燃烧时,火苗高且亮,即使在白天,二百米以外也能清晰可见.下列关于丁烷的叙述不正确的是( )
| A. | 丁烷由碳、氢两种元素组成 | |
| B. | 丁烷由4个碳原子和10个氢原子构成 | |
| C. | 丁烷中碳、氢元素的质量比是24:5 | |
| D. | 丁烷分子由碳原子和氢原子构成 |
15.生活中处处有化学,下列叙述错误的是( )
| A. | 医用酒精的浓度通常为75% | |
| B. | 保鲜膜、一次性食品袋的主要成分是聚氯乙烯 | |
| C. | 氧化钙用作儿童食品的干燥剂存在安全隐患 | |
| D. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 |