题目内容
8.常温下1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )| A. | 9.0 | B. | 9.5 | C. | 1 0.5 | D. | 1 1.0 |
分析 酸碱中和的实质为:H++OH-=H2O,当强酸和强碱溶液恰好反应时,溶液中氢离子与氢氧根离子的物质的量相等,据此列式计算出强碱溶液的pH.
解答 解:根据题意可知,一元强酸和一元强碱恰好反应,则溶液中H+与OH-的物质的量相等,
设强酸的体积为V,则强碱的体积为10V,
则:V•10-2.5=10V•10pH-14,
解得:pH=10.5,
故选C
点评 本题考查了溶液pH的简单计算,题目难度不大,明确溶液酸碱性与溶液pH的关系即可解答,注意掌握中和反应的实质,试题培养了学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.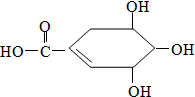 防治禽流感病毒是目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如图所示,下列关于莽草酸的说法正确的是( )
防治禽流感病毒是目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如图所示,下列关于莽草酸的说法正确的是( )
 防治禽流感病毒是目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如图所示,下列关于莽草酸的说法正确的是( )
防治禽流感病毒是目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如图所示,下列关于莽草酸的说法正确的是( )| A. | 莽草酸的分子之间不能发生酯化反应 | |
| B. | 莽草酸的分子式为C7H10O5 | |
| C. | 莽草酸中含有苯环 | |
| D. | 莽草酸不能使溴水褪色 |
1.草酸与高锰酸钾在酸性条件下反生反应离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
(1)如果研究催化剂对化学反应速率的影响,使用实验Ⅰ 和Ⅱ(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验Ⅰ和Ⅲ.
(2)对比实验Ⅰ和Ⅳ,可以研究硫酸的浓度或氢离子浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保溶液总体积不变.
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 |
(2)对比实验Ⅰ和Ⅳ,可以研究硫酸的浓度或氢离子浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保溶液总体积不变.
13.150℃时,将1L混合烃与9L氧气混合,在密闭容器内充分燃烧,当恢复至150℃,体积恒定时,容器内压强增大8%,则该混合烃的组成是( )
| A. | 甲烷与乙烷体积比是1:4 | B. | 丙炔与乙炔体积比是1:4 | ||
| C. | 乙烯与丁烷体积比是1:4 | D. | 乙烯与丁烯体积比是1:4 |