题目内容
【题目】以天然气代替石油生产液体燃料和基础化学品是当前化学研究和发展的重点。
(1)我国科学家创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产乙烯、芳香烃Y和芳香烃Z等重要化工原料,实现了CO2的零排放,碳原子利用率达100%。已知Y、Z的相对分子质量分别为78、128,其一氯代物分别有1种和2种。
①有关化学键键能数据如表中所示:
化学键 | H-H | C=C | C-C | C≡C | C-H |
E(kJ/mol) | 436 | 615 | 347.7 | 812 | 413.4 |
写出甲烷一步生成乙烯的热化学方程式_________________________,反应中硅化物晶格限域的单中心铁催化剂的作用是________________________;
②已知:原子利用率=期望产物总质量/反应物总质量×100%,则甲烷生成芳香烃Y的原子利用率为___________;
③生成1 mol Z产生的H2约合标准状况下________L。
(2)如图为乙烯气相直接水合法制备乙醇中乙烯的平衡转化率与温度、压强的关系
(其中n(H2O):n(C2H4)=1:1)。

①若p2=8.0 MPa,列式计算A点的平衡常数Kp=____________(用平衡分压代替平衡浓度计算;分压=总压×物质的量分数;结果保留到小数点后两位);
②该反应为__________(填“吸热”或“放热”)反应,图中压强(p1、p2、p3、p4)的大小关系为____________,理由是________________;
③气相直接水合法常采用的工艺条件:磷酸/硅藻土为催化剂,反应温度为290℃,压强为6.9 MPa,n(H2O):n(C2H4)=0.6:1。乙烯的转化率为5%,若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有______________(任写两条)。
(3)乙烯可以作为燃料电池的负极燃料,请写出以熔融碳酸盐作为电解质时,负极的电极反应式________________________________。
【答案】 2CH4(g)=C2H4(g)+2H2(g) ΔH=+166.6 kJ/mol 降低反应活化能,加快反应速率 81.25% 179.2 L 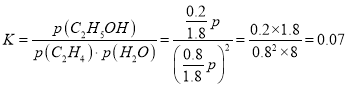 MPa 放热 p1<p2<p3<p4 该反应为反应后气体体积减小的反应,温度不变时,增大压强乙烯的转化率增大 将产物乙醇液化移去,或增大水与乙烯的比例 C2H4-12e-+6CO32-=8CO2+2H2O
MPa 放热 p1<p2<p3<p4 该反应为反应后气体体积减小的反应,温度不变时,增大压强乙烯的转化率增大 将产物乙醇液化移去,或增大水与乙烯的比例 C2H4-12e-+6CO32-=8CO2+2H2O
【解析】甲烷一步生产乙烯、芳烃Y和Z,反应过程本身实现了CO2的零排放,即碳原子守恒,Y、Z的相对分子质量分别为78、128,且X、Y的核磁共振氢谱只有一个峰,Z的核磁共振氢谱有二个峰,则X为CH2=CH2,Y为苯,Z为对(CH3)3CCH2C(CH3),
①甲烷一步生成CH2=CH2,断裂碳氢键,形成碳碳双键,根据题中化学键的键能数据可知该反应的反应热△H=(8×413.4-4×413.4-615-2×436.0)kJ/mol=+166.6kJ/mol,所以热化学方程式为2CH4(g)![]() C2H4(g)+2H2(g)△H=+166.6kJ/mol,硅化物晶格限域的单中心铁催化剂的作用是降低反应的活化能,加快反应的速率;
C2H4(g)+2H2(g)△H=+166.6kJ/mol,硅化物晶格限域的单中心铁催化剂的作用是降低反应的活化能,加快反应的速率;
②甲烷生成苯的反应方程式为6CH4→![]() +9H2,所以原子利用率为
+9H2,所以原子利用率为![]() ×100%=81.25%;
×100%=81.25%;
③由甲烷生成1 mol(CH3)3CCH2C(CH3) ,根据原子守恒,参加反应的甲烷为9mol,同时生成氢气的物质的量为![]() =8mol,体积为8mol×22.4L/mol=179.2 L;
=8mol,体积为8mol×22.4L/mol=179.2 L;
(2)① C2H4(g)+H2O(g)═C2H5OH(g)
开始:1 1 0
转化:0.2 0.2 0.2
平衡:0.8 0.8 0.2
乙醇占![]() =
=![]() ,乙烯和水各占
,乙烯和水各占![]() =
=![]() ,则乙醇的分压为8.0 MPa×
,则乙醇的分压为8.0 MPa×![]() ,A点的平衡常数
,A点的平衡常数 MPa;
MPa;
②在恒压条件下,温度升高,乙烯的转化率降低,则平衡逆向移动,该反应为放热反应,在相同温度下由于乙烯转化率为p1<p2<p3<p4,由C2H4(g)+H2O(g)═C2H5OH(g)可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是p1<p2<p3<p4,
③若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改变物质的浓度,如从平衡体系中将产物乙醇分离出来,或增大水蒸气的浓度,改变二者物质的量的比等;
(3)负极上乙烯失电子被氧化生成CO2,其电极反应式为C2H4-12e-+6CO32-=8CO2+2H2O。

【题目】下列有机物命名及其一氯代物的同分异构体数目均正确的是
命名 | 一氯代物 | |
A | 3—丁炔 | 3 |
B | 1,3-二甲基苯 | 3 |
C | 2-甲基-2-乙基丙烷 | 4 |
D | 2,3-二甲基-4-乙基己烷 | 7 |
A. A B. B C. C D. D


