题目内容
下列溶液中一定呈中性的是( )
| A、PH=7的溶液 |
| B、c(H+)=c( OH-)的溶液 |
| C、盐溶液 |
| D、既含有H+ 又含有OH-的溶液 |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:溶液呈酸碱性本质,取决与溶液中H+浓度与OH-浓度的相对大小,当溶液中:c(H+)>c(OH-),溶液呈酸性;c(H+)=c(OH-),溶液呈中性;c(H+)<c(OH-),溶液呈碱性;常温下,水的离子积Kw=1×10-14,所以,pH<7,溶液呈酸性;pH=7,溶液呈中性;pH>7,溶液呈碱性.Kw受温度影响,水的电离是吸热反应,温度越高Kw越大,据此进行判断.
解答:
解:A.pH=7的溶液,不一定是常温下,水的离子积不一定是Kw=1×10-14,溶液中c(H+)、c(OH-)不一定相等,故A错误;
B.溶液呈酸碱性本质,取决与溶液中H+浓度与OH-浓度的相对大小,溶液中氢离子浓度等于氢氧根离子浓度,溶液一定显示中性,故B正确;
C.强酸弱碱盐,水溶液显酸性;强碱弱酸盐,水溶液显碱性,故C错误;
D.酸性、中性、碱性溶液中都既含有H+又含有OH-,故D错误,
故选B.
B.溶液呈酸碱性本质,取决与溶液中H+浓度与OH-浓度的相对大小,溶液中氢离子浓度等于氢氧根离子浓度,溶液一定显示中性,故B正确;
C.强酸弱碱盐,水溶液显酸性;强碱弱酸盐,水溶液显碱性,故C错误;
D.酸性、中性、碱性溶液中都既含有H+又含有OH-,故D错误,
故选B.
点评:本题考查溶液酸碱性的判断,难度不大.要注意溶液的酸碱性是由溶液中H+浓度与OH-浓度的相对大小决定的,而不在于c(H+)或c(OH-)绝对值的大小.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
下列有关胶体的叙述不正确的是( )
| A、胶体粒子直径在1-100nm之间 |
| B、氢氧化铁胶体属于纯净物 |
| C、净水剂在水中形成的分散系是胶体 |
| D、光束通过胶体时有丁达尔效应 |
某高分子化合物是制造彩电荧光屏的原料之一,其结构简式为: ,下列有关该高分子化合物的说法不正确的是( )
,下列有关该高分子化合物的说法不正确的是( )
 ,下列有关该高分子化合物的说法不正确的是( )
,下列有关该高分子化合物的说法不正确的是( )| A、不易溶于水 |
| B、可以发生酯化反应 |
| C、可以发生加成反应 |
| D、水解后能得到分子式为C9H8O2的产物 |
“化学是人类进步的关键”.下列有关说法能反映正确化学观点的是( )
| A、改变物质的性质不一定要通过化学变化 |
| B、天然物质都比人造物质好 |
| C、一种元素可有多种离子,但只有一种原子 |
| D、根据分散系是否具有丁达尔效应,分散系分为溶液、胶体和浊液 |
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A、1mol?L-1的甲酸溶液的pH约为2 |
| B、甲酸能与水以任意比例互溶 |
| C、甲酸与盐酸都能与NaOH发生反应 |
| D、甲酸溶液的导电能力比盐酸溶液的导电能力弱 |
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
| A、1mol/L氢氰酸溶液能电离出H+ |
| B、HCN易溶于水 |
| C、10mL 1mol/L HCN恰好与10mL 1mol/L NaOH溶液完全反应 |
| D、在相同条件下,HCN溶液的导电性比强酸溶液的弱 |
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个未成对电子;E的原子序数为28;D与E同周期,价电子数为2.则下列说法正确的是( )
| A、元素A、B、C的氢化物的稳定性顺序:A>B>C |
| B、元素A、B、C、D的原子半径大小顺序:D>A>B>C |
| C、元素E的基态原子的外围电子排布式:3d10 |
| D、元素B、C、D形成的化合物DB2和DC2都是离子化合物,且阴阳离子数之比都为2:1 |
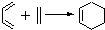 .
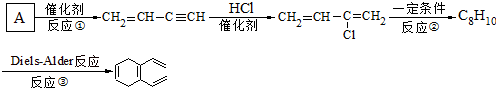
.
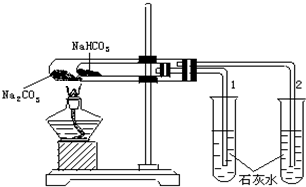 实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:
实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答: