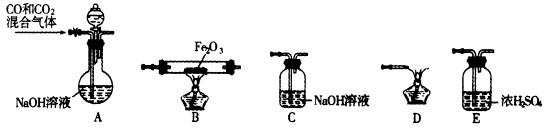
题目内容
大理石中含有的主要杂质是氧化铁,以下是某化学兴趣小组用大理石为原料制取安全无毒杀菌剂过氧化钙的主要流程: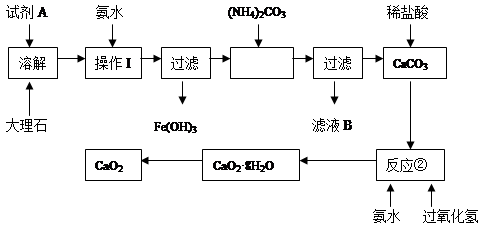
请回答下列问题:
(1)试剂A的名称是 ;
(2)操作I的目的是 ;
(3)本实验需要多次使用过滤,过滤中“一贴”“二低”“三靠”,其中“二低”指 ;
(4)写出反应②中生成CaO2·8H2O的化学方程式: ;
(1)硝酸或盐酸(2分)
(2)调节溶液的pH,使Fe3+完全沉淀(2分)
(3)滤纸顶部低于漏斗口、水面低于滤纸顶部(2分)
(4)CaC12 + H2O2 + 2NH3 + 8H2O ═ CaO2·8H2O↓ + 2NH4Cl (2分)
解析试题分析:本题是通过除去大理石中氧化铁制备过氧化钙的流程,溶解大理石需要用稀硝酸或盐酸,加入氨水显然是生成氢氧化铁过滤去除。反应②加入的反应物为氨水、过氧化氢及氯化钙,故反应为CaC12 + H2O2 + 2NH3 + 8H2O ═ CaO2·8H2O↓ + 2NH4Cl 。
考点:考查工业流程中有关试剂的选择、基本操作方法及目的有关问题。

下列实验中需使用温度计的有 ( )
| A.苯与溴的取代反应 | B.苯的硝化反应 | C.乙酸乙酯的制取 | D.石油的分馏 |
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为: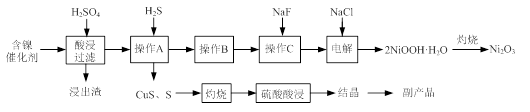
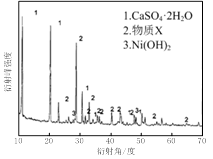
图Ⅰ 图Ⅱ
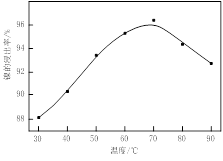
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价: (若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
利用反应I2(s)+Cl2(g)=2ICl(l),实验室可用如下图所示装置(加热、夹持仪器已略去)制取少量IC1。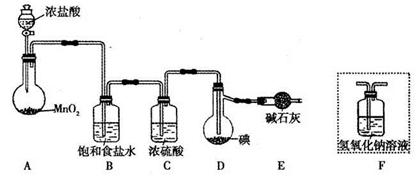
已知:ICl的熔点为13.9℃,沸点为97.4℃,易水解,且能发生反应:
ICl(l)+Cl2(g)=2ICl3(l)
(1)装置A中发生反应的化学方程式是____________。
(2)装置B的作用是______。不能用装置F代替装置E,理由是____________。
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是______ (填标号)。
| A.过滤 | B.蒸发结晶 | C.蒸馏 | D.分液 |
i.

ii.ICl+KI=I2+KCl
iii.I2+2Na2S2O3=2NaI+Na2S4O6
实验1:将0.500g该油脂样品溶于10mL四氯化碳后,加人20mL某ICl的冰醋酸溶液(过量),充分反应后,加人足量KI溶液,生成的碘单质用a mol?L—1的Na2S2O3,标准溶液滴定。经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL。
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL。
①滴定过程中可用______作指示剂。
②滴定过程中需要不断振荡,否则会导致V1______(填“偏大”或“偏小”)。
③0.500g该油脂样品所消耗的ICl的物质的量为______mol。由此数据经换算即可求得该油脂的不饱和度。
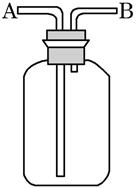
中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题: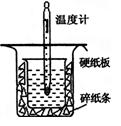
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是_________ _,除此之外,装置中的一个明显错误是 。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于________ ___。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量 (填“相等”、“不相等”),若实验操作均正确,则所求中和热 填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。 (从下列选出)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:________。 (从下列选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=______ ____ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____ ____。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中


 。
。