题目内容
按要求完成下列各题.
(1)AgNO3的水溶液呈______(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):______
______;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,其中加入硝酸目的是______.
(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是______.
(3)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______.
(4)某温度下(Kw=10-13),SnCl2溶液中由水电离的c(H+)=10-4mol?L-1,则该溶液的pH为______.
(5)已知:2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-akJ/mol;2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-bkJ/mol
则H2S与SO2气体混合生成固体硫和液态水的热化学方程式为______.
(1)AgNO3的水溶液呈______(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):______
______;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,其中加入硝酸目的是______.
(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是______.
(3)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______.
(4)某温度下(Kw=10-13),SnCl2溶液中由水电离的c(H+)=10-4mol?L-1,则该溶液的pH为______.
(5)已知:2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-akJ/mol;2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-bkJ/mol
则H2S与SO2气体混合生成固体硫和液态水的热化学方程式为______.
(1)硝酸银是强酸弱碱盐,水溶液中银离子水解显酸性,反应的离子方程式为:Ag++H2O?AgOH+H+;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,其中加入硝酸目的是抑制硝酸银水解,避免溶液变浑浊;故答案为:酸性;Ag++H2O?AgOH+H+;抑制硝酸银水解;
(2)氯化铁水解生成氢氧化铁和盐酸,加热氯化氢挥发,促进水解平衡进行,得到固体氢氧化铁,灼烧氢氧化铁分解生成氧化铁和水,所以得到固体为Fe2O3;故答案为:Fe2O3;
(3)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,溶液中氢离子物质的量和氢氧根离子物质的量相同,pH=9的NaOH溶液中C(OH-)=10-5mol/L,pH=4的H2SO4溶液中氢离子浓度C(H+)=10-4mol/L;设酸、碱溶液体积为V(酸),V(碱),依据中和反应后溶液呈中性得到:10-5mol/L×V(碱)=10-4mol/L×V(酸),得到V(碱):V(酸)=10:1;
故答案为:10:1;
(4)某温度下(Kw=10-13),SnCl2溶液中由水电离的c(H+)=10-4mol?L-1,SnCl2溶液中存在水解平衡为:Sn2++H2O?Sn(OH)Cl+H+;则该溶液的pH依据溶液中氢离子浓度计算为PH=-lg[H+]=-Lg10-4mol/L=4;
故答案为:4;
(5)①2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-akJ/mol;②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-bkJ/mol;
依据盖斯定律①×3-②得到:4H2S(g)+2SO2(g)=6S(s)+4H2O(l)△H=+(b-3a) kJ/mol
则H2S与SO2气体混合生成固体硫和液态水的热化学方程式:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=+(b-3a)/2 kJ/mol;
故答案为:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=+(b-3a)/2 kJ/mol;
(2)氯化铁水解生成氢氧化铁和盐酸,加热氯化氢挥发,促进水解平衡进行,得到固体氢氧化铁,灼烧氢氧化铁分解生成氧化铁和水,所以得到固体为Fe2O3;故答案为:Fe2O3;
(3)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,溶液中氢离子物质的量和氢氧根离子物质的量相同,pH=9的NaOH溶液中C(OH-)=10-5mol/L,pH=4的H2SO4溶液中氢离子浓度C(H+)=10-4mol/L;设酸、碱溶液体积为V(酸),V(碱),依据中和反应后溶液呈中性得到:10-5mol/L×V(碱)=10-4mol/L×V(酸),得到V(碱):V(酸)=10:1;
故答案为:10:1;
(4)某温度下(Kw=10-13),SnCl2溶液中由水电离的c(H+)=10-4mol?L-1,SnCl2溶液中存在水解平衡为:Sn2++H2O?Sn(OH)Cl+H+;则该溶液的pH依据溶液中氢离子浓度计算为PH=-lg[H+]=-Lg10-4mol/L=4;
故答案为:4;
(5)①2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-akJ/mol;②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-bkJ/mol;
依据盖斯定律①×3-②得到:4H2S(g)+2SO2(g)=6S(s)+4H2O(l)△H=+(b-3a) kJ/mol
则H2S与SO2气体混合生成固体硫和液态水的热化学方程式:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=+(b-3a)/2 kJ/mol;
故答案为:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=+(b-3a)/2 kJ/mol;

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目

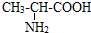
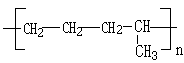
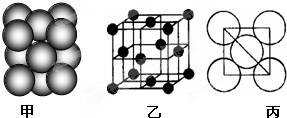

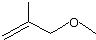 的分子式是
的分子式是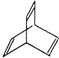 有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式
有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式