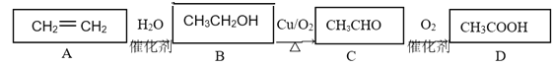
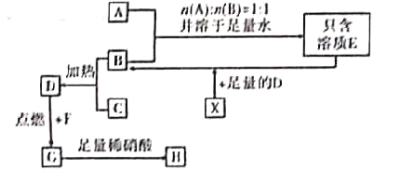
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ“‘Μ‘Ά≠ΩσΈΣ‘≠Νœ…ζ≤ζΦν ΫΧΦΥαΆ≠ΒΡΙΛ“’Νς≥Χ»γΆΦΥυ ΨΘΚ
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©»τ“ΣΧαΗΏΜ‘Ά≠Ωσλ―…’–߬ Ω…≤…»ΓΒΡ¥κ ©”–___Θ®ΧνΝΫ÷÷Θ©ΓΘ
Θ®2Θ©ΤχΧεXΒΡ÷ς“Σ≥…Ζ÷ «___Θ®ΧνΜ·―ß ΫΘ©Θ§–¥≥ωΗΟΤχΧεΒΡ“Μ÷÷”ΟΆΨ___ΓΘ
Θ®3Θ©’τΑ±Ιΐ≥ΧΉήΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ «___ΓΘ
Θ®4Θ©»ή“ΚE”κNa2CO3»ή“ΚΖ¥”Π÷Τ»ΓCu2(OH)2CO3ΒΡάκΉ”Ζ¥”ΠΖΫ≥Χ ΫΈΣ___ΓΘ
Θ®5Θ©Ρ≥ Β―ι–ΓΉι―–ΨΩ»ή“ΚE”κNa2CO3»ή“ΚΦ”ΝœΥ≥–ρΦΑΦ”ΝœΖΫ ΫΕ‘≤ζΤΖΒΡ”ΑœλΘ§ Β―ιΫαΙϊ»γœ¬ΘΚ
Β―ι–ρΚ≈ | Φ”ΝœΥ≥–ρΦΑΖΫ Ϋ | ≥ΝΒμ―’…Ϊ | ≥ΝΒμΤΖ÷ | ≤ζ¬ /% |
1 | »ή“ΚE“Μ¥ΈΦ”»κNa2CO3»ή“Κ÷–≤Δ―ΗΥΌΫΝΑη | «≥άΕ…Ϊ | ΤΖ÷ ΫœΚΟ | 87.8 |
2 | »ή“ΚE÷πΒΈΦ”»κNa2CO3»ή“Κ÷–≤Δ≤ΜΕœΫΝΑη | ΑΒάΕ…Ϊ | ΤΖ÷ ΚΟ | 71.9 |
3 | Na2CO3»ή“Κ“Μ¥ΈΦ”»κ»ή“ΚE÷–≤Δ―ΗΥΌΫΝΑη | «≥¬Χ…Ϊ | ΤΖ÷ ΚΟ | 96.7 |
4 | Na2CO3»ή“Κ“Μ¥ΈΦ”»κ»ή“ΚE÷–≤Δ≤ΜΕœΫΝΑη | «≥άΕ…Ϊ | ΤΖ÷ ΫœΚΟ | 102.7 |
”……œ±μΩ…÷Σ÷Τ»ΓCu2(OH)2CO3ΉνΦ―Φ”ΝœΥ≥–ρΦΑΦ”ΝœΖΫ Ϋ «___Θ®Χν–ρΚ≈Θ©ΓΘ
ΓΨ¥πΑΗΓΩΦθ–ΓΜ‘Ά≠ΩσΩ≈ΝΘ¥σ–ΓΓΔ Β±ΧαΗΏλ―…’Έ¬Ε»ΓΔ‘ω¥σO2≈®Ε»Β» SO2 ÷Τ±ΗΝρΥαΓΔΤ·ΑΉΦΝΓΔΖάΗ·ΦΝΒ» [Cu(NH3)4]Cl2+H2O![]() CuO+2HClΓϋ+4NH3Γϋ 2Cu2++2CO32-+H2O=Cu2(OH)2CO3Γΐ+CO2Γϋ 3
CuO+2HClΓϋ+4NH3Γϋ 2Cu2++2CO32-+H2O=Cu2(OH)2CO3Γΐ+CO2Γϋ 3
ΓΨΫβΈωΓΩ
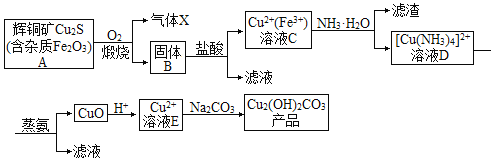
Μ‘Ά≠ΩσΆ®»κ―θΤχ≥δΖ÷λ―…’Θ§…ζ≥…Εΰ―θΜ·ΝρΤχΧεΘ§ΙΧΧεB÷ς“ΣΈΣCuOΓΔFe2O3Θ§Φ”»κ―ΈΥαΒΟΒΫΚ§”–Cu2+ΓΔFe3+ΒΡ»ή“ΚΘ§Φ”»κΙΐΝΩΑ±Υ°Θ§Ω…ΒΟΒΫ[Cu(NH3)4]2+ΚΆFe(OH)3Θ§[Cu(NH3)4]2+Ψ≠Φ”»»Ω…ΒΟΒΫCuOΘ§Φ”»κΥαΥαΜ·ΒΟΒΫCu2+Θ§Ψ≠≈®ΥθΚσ‘Ύ»ή“Κ÷–Φ”»κΧΦΥαΡΤΩ…ΒΟΒΫΦν ΫΧΦΥαΆ≠Θ§“‘¥ΥΫβ¥πΗΟΧβΓΘ
(1)Ά®ΙΐΖέΥιΜ‘Ά≠ΩσΦθ–ΓΜ‘Ά≠ΩσΩ≈ΝΘ¥σ–ΓΓΔ Β±ΧαΗΏλ―…’Έ¬Ε»ΓΔ‘ω¥σO2≈®Ε»Β»¥κ ©ΨυΩ…ΧαΗΏΜ‘Ά≠Ωσλ―…’–߬ ΘΜ
(2)Cu2SΩ…”κ―θΤχΖ¥”Π…ζ≥…Εΰ―θΜ·ΝρΘ§‘ρΤχΧεXΒΡ÷ς“Σ≥…Ζ÷ «SO2Θ§SO2 «Υα–‘―θΜ·ΈοΘ§”–Τ·ΑΉ–‘ΓΔΜΙ‘≠–‘Θ§‘ράϊ”ΟSO2÷Τ±ΗΝρΥαΓΔΤ·ΑΉΦΝΓΔΖάΗ·ΦΝΒ»ΘΜ
(3)’τΑ±Ιΐ≥Χ[Cu(NH3)4]2+Ψ≠Φ”»»Ω…ΒΟΒΫCuOΘ§Ζ¥”ΠΒΡΖΫ≥Χ ΫΈΣ[Cu(NH3)4]Cl2+H2O![]() CuO+2HClΓϋ+4NH3ΓϋΘΜ
CuO+2HClΓϋ+4NH3ΓϋΘΜ
(4)œρΚ§”–Cu2+ΒΡ»ή“Κ÷–ΒΈΦ”Na2CO3»ή“Κ…ζ≥…Cu2(OH)2CO3ΒΡάκΉ”Ζ¥”ΠΖΫ≥Χ ΫΈΣ2Cu2++2CO32-+H2O=Cu2(OH)2CO3Γΐ+CO2ΓϋΘΜ
(5)”…ΆΦ±μ–≈œΔΩ…÷ΣNa2CO3»ή“Κ“Μ¥ΈΦ”»κ»ή“ΚE÷–≤Δ―ΗΥΌΫΝΑηΘ§ΜώΒΟ«≥¬Χ…ΪΒΡΦν ΫΧΦΥαΆ≠Θ§ΤΖ÷ ΚΟΘ§«“≤ζ¬ ΗΏΘ§Ι ÷Τ»ΓCu2(OH)2CO3ΉνΦ―Φ”ΝœΥ≥–ρΦΑΦ”ΝœΖΫ Ϋ « Β―ι–ρΚ≈3ΓΘ

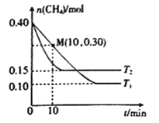
ΓΨΧβΡΩΓΩ‘ΎΡ≥»ή“ΚM÷–ΒΈΦ”»ή“Κx(ΜρΆ®»κΤχΧεx)Θ§ΈοάμΝΩy”κxΧεΜΐΒΡΙΊœΒ»γΆΦΥυ ΨΓΘœ¬Ν–”–ΙΊ»ή“ΚMΓΔxΚΆΈοάμΝΩyΖϊΚœΆΦœώΫΜΜ·ΒΡ «
―Γœν | M | x | y |
A | Κ§Mg2ΘΪΓΔAl3ΘΪΓΔNH4ΘΪΒΡ»ή“Κ | KOH»ή“Κ | ≥ΝΒμΒΡΈο÷ ΒΡΝΩ |
B | Κ§CO32Θ≠ΓΔHCO3Θ≠ΒΡ»ή“Κ | ―ΈΥα | Εΰ―θΜ·ΧΦΒΡΧεΜΐ |
C | Κ§OHΘ≠ΓΔAlO2Θ≠ΓΔSiO32Θ≠ΓΔCO32Θ≠ΒΡ»ή“Κ | NaHSO4»ή“Κ | ≥ΝΒμΒΡ÷ ΝΩ |
D | Κ§Ba(OH)2ΓΔNaOHΓΔNaAlO2ΒΡ»ή“Κ | CO2 | ≥ΝΒμΒΡΈο÷ ΒΡΝΩ |
A.AB.BC.CD.D