题目内容
3.在强碱性溶液中能大量共存且溶液为无色透明的离子组是( )| A. | Na+、K+、SO42-、MnO4- | B. | Na+、NH4+、NO3-、Cl- | ||
| C. | K+、Ba2+、HCO3-、Cl- | D. | K+、Na+、CO32-、NO3- |
分析 溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,强碱性溶液中存在大量氢氧根离子,
A.高锰酸根离子为有色离子,不满足溶液无色的条件;
B.铵根离子与氢氧根离子反应;
C.碳酸氢根离子与氢氧根离子反应;
D.四种离子之间不反应,都不与氢氧根离子反应,且为无色溶液.
解答 解:无色溶液时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,强碱性溶液中存在大量氢氧根离子,
A.MnO4-为有色离子,不满足溶液无色的要求,故A错误;
B.NH4+与强碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.Ba2+、HCO3-与氢氧根离子反应生成碳酸钡沉淀,在溶液中不能大量共存,故C错误;
D.K+、Na+、CO32-、NO3-之间不发生反应,都不与氢氧根离子反应,且都是无色离子,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.电子云图中的小黑点表示的意义是( )
| A. | 一个小黑点表示一个电子 | B. | 黑点的多少表示电子个数的多少 | ||
| C. | 表示电子运动的轨迹 | D. | 电子在核外空间出现机会的多少 |
14.下列物质所含的化学键只有离子键的是( )
| A. | Na2O2 | B. | HCl | C. | KOH | D. | CaCl2 |
11.下面列出了几组物质,请将物质的合适组号填写在空格上.
①金刚石与“足球烯”C60; ②D与T ③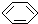 和
和
④O2与 O3 ⑤淀粉和纤维素 ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑦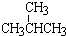 与
与 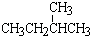 ; ⑧35Cl和37Cl
; ⑧35Cl和37Cl
⑨
⑩CH2=CH-CH2CH3和CH3-CH=CH-CH3
①金刚石与“足球烯”C60; ②D与T ③
 和
和
④O2与 O3 ⑤淀粉和纤维素 ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑦
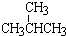 与
与 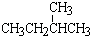 ; ⑧35Cl和37Cl
; ⑧35Cl和37Cl⑨

⑩CH2=CH-CH2CH3和CH3-CH=CH-CH3
| 各组物质互为 | 同位素 | 同素异形体 | 同分异构体 | 同系物 |
| 填写序号 |
18.在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入a mol及b mol碘化氢(a>b),待反应2HI?I2(g)+H2(g)达平衡后,下列说法肯定正确的是( )
| A. | 从反应开始到建立平衡所需时间:tA<tB | |
| B. | 平衡时I2的浓度:c(I2)A=c(I2)B | |
| C. | 平衡时碘蒸气在混合气体中的百分含量:A容器大于B容器 | |
| D. | 平衡时HI的分解率:αA=αB |
12.现有几个离子反应:
①Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O
②2Fe2++Br2═2Fe3++2Br-
③2Fe3++SO2+2H2O═2Fe2++SO42-+4H+
下列有关性质的比较中正确的是( )
①Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O
②2Fe2++Br2═2Fe3++2Br-
③2Fe3++SO2+2H2O═2Fe2++SO42-+4H+
下列有关性质的比较中正确的是( )
| A. | 氧化性:Cr2O72->Cl2>Fe3+ | B. | 氧化性:Cl2>Br2>Cr2O72- | ||
| C. | 还原性:SO2<Fe2+<Br- | D. | 还原性:Cl->Cr3+>Fe2+ |
13.500℃条件下,在恒容密闭容器中,充入1mol NO2存在如下平衡2NO2(g)?N2O4(g),平衡后,向容器内再充入1mol NO2,下列说法正确的( )
| A. | 平衡向逆反应方向移动 | |
| B. | 平衡常数K增大 | |
| C. | NO2的转化率变小 | |
| D. | 容器内气体颜色先变深后变浅,最后比原平衡还要深 |
 效成分,其过程称为萃取;从碘水中提取碘采用萃取(或萃取分液)操作.
效成分,其过程称为萃取;从碘水中提取碘采用萃取(或萃取分液)操作.