题目内容
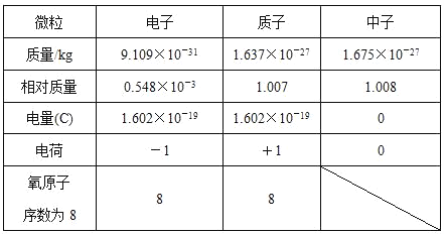
【题目】根据下表中的电子、质子和中子的基本数据,讨论回答问题:
(1)决定原子质量的主要微粒是____________。
(2)原子相对质量的计算方法是_____________。
(3)如果1个质子和1个中子的相对质量都近似等于1,其原子的相对质量近似等于____________。
(4)原子中质子数、中子数、质量数之间的关系是_____。
(5)确定原子中质子数的方法是_________
(6)原子显电中性的原因是__________
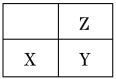
(7)质子数为Z,质量数为A的X元素原子的组成符号是____。
【答案】质子和中子 ![]() 等于质子数与中子数之和(质量数) 质量数=质子数+中子数 质子数=核电荷数=原子序数=核外电子数=质量数-中子数 原子核所带正电荷数与核外电子所带负电荷数相等
等于质子数与中子数之和(质量数) 质量数=质子数+中子数 质子数=核电荷数=原子序数=核外电子数=质量数-中子数 原子核所带正电荷数与核外电子所带负电荷数相等 ![]()
【解析】
(1)![]() 中X表示元素符号,Z表示该原子的核内质子数,A表示该原子的质量数;X原子的相对原子质量近似等于质量数A。
中X表示元素符号,Z表示该原子的核内质子数,A表示该原子的质量数;X原子的相对原子质量近似等于质量数A。
(2)构成原子的粒子间的三个关系:
质量关系:质量数(A)=质子数(Z)+中子数(N)
数量关系:核电荷数=质子数=核外电子数
电性关系:原子
(1)决定原子质量大小的微粒主要是:质子和中子(或原子核);
(2)相对原子质量的概念是以一种碳原子(即碳-12原子)质量的1/12作为标准,其它原子的质量(实际质量)跟它相比较所得的值,就称为该原子的相对原子质量,则原子相对质量的计算方法是 ;
;
(3)质子、中子的相对质量约为1,故相对原子质量近似等于=质子数+中子数=质量数;
(4)原子中质子数、中子数、质量数之间的关系是质量数=质子数+中子数;
(5)在原子结构中原子核内质子数=核电荷数=原子序数=核外电子数=质量数-中子数;
(6)原子显电中性的原因是原子核所带正电荷数与核外电子所带负电荷数相等,代数和为0;
(7)质子数为Z,质量数为A的X元素原子的组成符号是![]() 。
。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】葡萄酒常用Na2S2O5作抗氧化剂。中华人民共和国国家标准(G112760-2011)规定葡萄酒中抗氧化剂的残留量(以游离SO2计算)不能超过0.25g/L。某化学兴趣小组制备并对SO2的化学性质和用途进行探究,探究过程实验装置如下图,并收集某葡萄酒中SO2,对其含量进行测定。(夹持仪器省略)
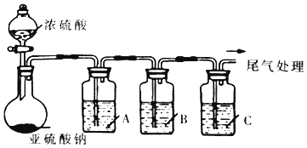
(1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等.
①请完成下列表格
试剂 | 作用 | |
A | _____________ | 验证SO2的还原性 |
B | Na2S溶液 | _____________ |
C | 品红溶液 | ______________ |
②A中发生反应的离子方程式为______________________________________
(2)该小组收集某300.00mL葡萄酒中SO2,然后用0.0900 mol/L NaOH标准溶液进行滴定,滴定前排气泡时,应选择下图中的_________(填序号);若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处时,管内液体的体积_____(填序号)(①= 10mL;②=40mL; ③<10mL;④>40mL)

(3)该小组在实验室中先配制0.0900 mol/L NaOH标准溶液,然后再用其进行滴定。下列操作会导致测定结果偏高的是________。
A.未用NaOH标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.配制溶液定容时,俯视刻度线
E.中和滴定时,观察标准液体积读数时,滴定前仰视,滴定后俯视
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为_______g/L。
【题目】下表是有机物 A、B、C、D 的有关信息:
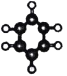
A | ①无色无味、难溶于水; ②最简单的有机化合物 | B | ①能使溴的四氯化碳溶液褪色; ②比例模型为: ③能与水在一定条件下反应生成 D |
C | ①由 C、H 两种元素组成; ②球棍模型为: | D | ①能与钠反应,但不能与 NaOH 溶液反应; ②在催化剂条件下能被空气中的氧气氧化为 E |
根据表中信息回答下列问题:
(1)写出B 的结构式_____;D 的官能团名称是_____。
(2)B 能使溴的四氯化碳溶液褪色,反应后生成物的名称_____。
(3)B→D 的化学反应类型为_____。
(4)D 催化氧化生成E 的化学方程式为_____。
(5)C 的分子式是_____,写出在浓硫酸作用下,C 在 50 ~60℃与浓硝酸发生反应的化学方程式:_____。
(6)与A 互为同系物的物质均符合通式 CnH2n+2,当 n=5 时,该有机物有_____种同分异构体, 其中碳链最短的同分异构体的结构简式是_____。