题目内容
【题目】葡萄酒常用Na2S2O5作抗氧化剂。中华人民共和国国家标准(G112760-2011)规定葡萄酒中抗氧化剂的残留量(以游离SO2计算)不能超过0.25g/L。某化学兴趣小组制备并对SO2的化学性质和用途进行探究,探究过程实验装置如下图,并收集某葡萄酒中SO2,对其含量进行测定。(夹持仪器省略)
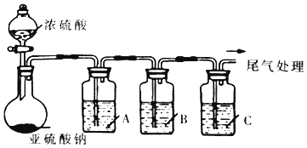
(1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等.
①请完成下列表格
试剂 | 作用 | |
A | _____________ | 验证SO2的还原性 |
B | Na2S溶液 | _____________ |
C | 品红溶液 | ______________ |
②A中发生反应的离子方程式为______________________________________
(2)该小组收集某300.00mL葡萄酒中SO2,然后用0.0900 mol/L NaOH标准溶液进行滴定,滴定前排气泡时,应选择下图中的_________(填序号);若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处时,管内液体的体积_____(填序号)(①= 10mL;②=40mL; ③<10mL;④>40mL)

(3)该小组在实验室中先配制0.0900 mol/L NaOH标准溶液,然后再用其进行滴定。下列操作会导致测定结果偏高的是________。
A.未用NaOH标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.配制溶液定容时,俯视刻度线
E.中和滴定时,观察标准液体积读数时,滴定前仰视,滴定后俯视
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为_______g/L。
【答案】FeCl3溶液 验证SO2的氧化性 验证SO2的漂白性 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ ③ ④ A、C 0.24
【解析】
(1)①由装置分析为制取SO2并检验SO2的性质问题,A.由所给的试剂知道2Fe3++ SO2+2H2O=2Fe2++4H++SO42+,该反应SO2表现还原性,所用的试剂FeCl3为氧化性;B.加入Na2S溶液会和SO2发生反应,S2-+ SO2+4H+=S![]() +2H20,此时SO2表现氧化性;C.品红溶液通入SO2后褪色。表现了SO2的漂白性。答案:FeCl3溶液验、SO2的氧化性、验证SO2的漂白性。
+2H20,此时SO2表现氧化性;C.品红溶液通入SO2后褪色。表现了SO2的漂白性。答案:FeCl3溶液验、SO2的氧化性、验证SO2的漂白性。
②由上述分析知道A中发生反应的离子方程式为:2Fe3++ SO2+2H2O=2Fe2++4H++SO42+ 。答案:2Fe3++ SO2+2H2O=2Fe2++4H++SO42+。
(2)因为氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用(3)的方法; 若用50 mL 滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有有40 mL刻度的溶液,另外滴定管50 mL刻度线下有液体,因此管内的液体体积>40mL所以(4)正确,因此,本题答案是:(3) ; (4);
(3)A.未用NaOH标准溶液润洗滴定管导致标准液稀释,使测量结果偏高;B.滴定前锥形瓶内有少量水因为稀释时需要加水,所以滴定前锥形瓶内有少量水不影响测量结果;
C.滴定前滴定管尖嘴部分有气泡。没有赶气泡导致消耗标准液体积增大,使测量结果偏高。
D.配制溶液定容时,俯视刻度线加水少了,导致标准液浓度偏大,导致测量结果偏低。
E.中和滴定时,观察标准液体积读数时,滴定前仰视,体积读大了,滴定后俯视体积读小了,结果消耗标准液的体积减小了,导致测量结果票低了。答案:A、C。
(4)根据2NaOH![]() H2SO4
H2SO4![]() SO2可以知道SO2的质量为:1/2
SO2可以知道SO2的质量为:1/2![]() 0.0900 mol/L
0.0900 mol/L![]() 0.025L
0.025L![]() g/mol=0.072g,该葡萄酒中的二氧化硫含量为: 0.072g/0.3L=0.24g/L;因此答案是:0.24;
g/mol=0.072g,该葡萄酒中的二氧化硫含量为: 0.072g/0.3L=0.24g/L;因此答案是:0.24;

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,c(NO)随时间的变化如表:
2NO2(g)体系中,c(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 0.10 | 0.05 | 0.04 | 0.03 | 0.03 | 0.03 |
(1)分析上表,该反应达到平衡状态所需时间是_________。
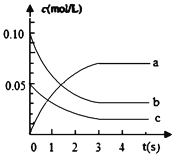
(2)上图中表示NO2的浓度变化曲线是_______________。
(3)用NO表示从0~2s内该反应的平均速率v=________。
(4)v(NO):v(O2) = ______________。
(5)达到平衡状态时O2的转化率为________。