题目内容
用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是
A.SO2、CS2、HI都是直线形的分子
B.BF3键角为120°,SnBr2键角大于120°
C.COCl2、BF3、SO3都是平面三角形的分子
D.PCl3、NH3、PCl5都是三角锥形的分子
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。回答下列问题:
(l)汽车发动机工作时会引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。2000K时,向容积为2L的密闭容器中充入2molN2与2molO2,发生上述反应,经过5min达到平衡,此时容器内NO的体积分数为0.75% .则该反应在5min内的平均反应速率v(O2)=_______mol/(Lmin),N2的平衡转化率为_______,2000K时该反应的平衡常数K=_____。
2NO(g),是导致汽车尾气中含有NO的原因之一。2000K时,向容积为2L的密闭容器中充入2molN2与2molO2,发生上述反应,经过5min达到平衡,此时容器内NO的体积分数为0.75% .则该反应在5min内的平均反应速率v(O2)=_______mol/(Lmin),N2的平衡转化率为_______,2000K时该反应的平衡常数K=_____。
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如右图所示。

① 反应2NO(g) N2(g)+O2(g)为______反应(填“吸热”或“放热”) ;
N2(g)+O2(g)为______反应(填“吸热”或“放热”) ;
②一定温度下,能够说明反应2NO(g) N2(g)+O2(g)已达到平衡的是_____(填序号);
N2(g)+O2(g)已达到平衡的是_____(填序号);
a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c. 2NO、N2、O2的浓度保持不变
d.单位时间内分解4molNO,同时生成2molN2
③ 在四个容积和温度均完全相同的密闭容器中分别加入下列物质,相应物质的量(mol)如下表所示。相同条件下达到平衡后,N2的体积分数最大的是_______(填容器代号);
容器代号 | NO | N2 | O2 |
A | 2 | 0 | 0 |
B | 0 | l | l |
C | 0.4 | 0.6 | 0.8 |
D | l | 0.5 | 0.4 |
(3)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx。可用CH4催化还原NOx以消除氮氧化物污染。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:___________;
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为___________________。


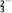 B. ClO
B. ClO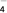 C. NO
C. NO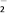 D. ClO
D. ClO



 (R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
