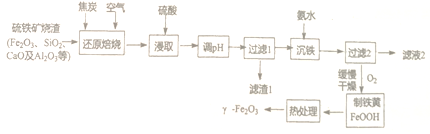
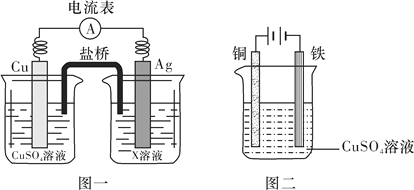
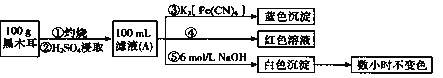
题目内容
【题目】一种常用融雪剂的主要成分的化学式为XY2,X原子的结构示意图为![]() ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该融雪剂的化学式为________。
(2)Z、W元素的名称为________、________。
(3)下列说法正确的是________。
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________。
A.XY2的电子式:![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-=2Y-+Z↓
D.用电子式表示XY2的形成过程为:![]()
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是________________________________。
【答案】20 CaCl2硫碳BB、D水分子间存在氢键
【解析】
(1)X原子的结构示意图![]() ,根据核外电子排布规律,a=2,b=8,可推知其为
,根据核外电子排布规律,a=2,b=8,可推知其为![]() ,该元素为Ca,m=20,根据CaY2可知Y为-1价,又因为Y-与Ca2+的电子层结构相同,可知Y为Cl;(2)Z、W原子的最外层电子数是其电子层数的2倍,则Z、W是C或S,Z与Y相邻,则Z是S,W是C,名称分别是硫和碳;(3)A、CaCl2是仅含离子键的离子化合物,CS2是仅含极性键的共价化合物,故A错误;B、根据A选项的分析,故B正确;C、S的非金属性弱于Cl,则H2S的稳定性比HCl弱,故C错误;D、Ca2+、Cl-具有相同的电子层结构,但Ca2+的核电荷数大,离子半径小,故D错误;(4)A、XY2为CaCl2,其电子式为
,该元素为Ca,m=20,根据CaY2可知Y为-1价,又因为Y-与Ca2+的电子层结构相同,可知Y为Cl;(2)Z、W原子的最外层电子数是其电子层数的2倍,则Z、W是C或S,Z与Y相邻,则Z是S,W是C,名称分别是硫和碳;(3)A、CaCl2是仅含离子键的离子化合物,CS2是仅含极性键的共价化合物,故A错误;B、根据A选项的分析,故B正确;C、S的非金属性弱于Cl,则H2S的稳定性比HCl弱,故C错误;D、Ca2+、Cl-具有相同的电子层结构,但Ca2+的核电荷数大,离子半径小,故D错误;(4)A、XY2为CaCl2,其电子式为![]() ,故A错误;B、WZ2为CS2,其空间结构类似与CO2,因此其结构式为S=C=S,故B正确;C、Y的单质为Cl2,H2Z为H2S,因为氯气的氧化性强于S,因此发生Cl2+H2S=2HCl+S↓,H2S的水溶液为弱酸,应写成分子式,即Cl2+H2S=2H++2Cl-+S↓,故C错误;D、CaCl2为离子化合物,根据CaCl2的电子式,故D正确;(5)H2O分子间存在氢键,H2S分子间不存在氢键,存在分子氢键物质的熔沸点高于不含有分子间的氢键的,故水的沸点高于H2S。
,故A错误;B、WZ2为CS2,其空间结构类似与CO2,因此其结构式为S=C=S,故B正确;C、Y的单质为Cl2,H2Z为H2S,因为氯气的氧化性强于S,因此发生Cl2+H2S=2HCl+S↓,H2S的水溶液为弱酸,应写成分子式,即Cl2+H2S=2H++2Cl-+S↓,故C错误;D、CaCl2为离子化合物,根据CaCl2的电子式,故D正确;(5)H2O分子间存在氢键,H2S分子间不存在氢键,存在分子氢键物质的熔沸点高于不含有分子间的氢键的,故水的沸点高于H2S。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案【题目】某化学兴趣小组,通过下图装置进行硫酸与铜反应的实验探究。
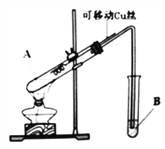
⑴提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
⑵设计实验:
实验编号 | 实验操作 | 实验现象 |
1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
实验前,试管B盛放的是_______________溶液(填“品红”或“酚酞”)。
⑶实验结论:通过以上实验,说明浓硫酸具有____________________(填写字母代号)。
A.强氧化性 B.脱水性 C.吸水性
⑷问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是________;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液__________(填字母编号);
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液。该溶液中Cu2+物质的量浓度为_____mol·L-1 。