题目内容
【题目】-Fe2O3是一种具有磁性、催化等作用的纳米材料,以硫铁矿烧渣等为原料生产制备-Fe2O3的流程如下:

已知:“还原焙烧”的主要反应为:3C+2O2![]() 3CO↑+CO2↑,Fe2O3+CO
3CO↑+CO2↑,Fe2O3+CO![]() 2FeO + CO2
2FeO + CO2
回答下列问题:
(1)“浸取”前需将焙烧生成的混合物粉碎,其目的是_____________________。
(2)“滤渣1”除了CaSO4外还有_______________。
(3)常温下Ksp[Al(OH)3]=1.3×10-33。当常温下溶液pH=6时,c(Al3+)=____________。
(4)“过滤2”时需用蒸馏水洗涤,能证明己洗涤干净的方法是______________;
(5)沉淀缓慢氧化为铁黄的化学方程式为_____________________。
【答案】 增大接触面积,加快反应速率,提高浸取率 SiO2、Al(OH)3 1.3×10-9mol/L 取最后一次洗涤滤液于试管,滴入盐酸酸化的BaCl2溶液,若无白色沉淀说明己洗涤干净 4Fe(OH)2+O2=4FeOOH+2H2O
【解析】试题分析:由流程中信息可知,烧渣在焙烧后氧化铁被还原为氧化亚铁,经硫酸溶解后,生成硫酸亚铁,同时氧化铝和氧化钙也与盐酸反应分别生成硫酸铝和硫酸钙,调节pH后,过滤,得到滤渣1的成分主要是硫酸钙、二氧化硅、和氢氧化铝,滤液中加入氨水后,硫酸亚铁沉淀为氢氧化亚铁,过滤后把氢氧化亚铁在氧气中缓慢干燥,氢氧化亚铁被氧化为铁黄。最后铁黄以热处理得到产品。
(1)“浸取”前需将焙烧生成的混合物粉碎,其目的是增大接触面积,加快反应速率,提高浸取率。
(2)“滤渣1”除了CaSO4外还有SiO2、Al(OH)3。
(3)常温下Ksp[Al(OH)3]=1.3×10-33。当常温下溶液pH=6时,c(OH-)=10-8mol/L,c(Al3+)= 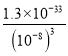 = 1.3×10-9mol/L。
= 1.3×10-9mol/L。
(4)“过滤2”时需用蒸馏水洗涤,能证明己洗涤干净的方法是检验硫酸根离子:取最后一次洗涤滤液于试管,滴入盐酸酸化的BaCl2溶液,若无白色沉淀说明己洗涤干净;
(5)沉淀缓慢氧化为铁黄的化学方程式为4Fe(OH)2+O2=4FeOOH+2H2O 。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案