题目内容
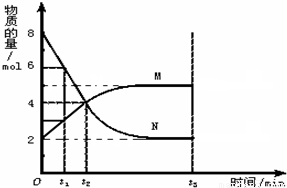
在一定温度下,在容积为2L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题:(1)该反应的化学方程式为 .?
(2)若t1=5S,则前5S用M表示的反应速率为 .
(3)t2时,正反应速率 逆反应速率(填大于.等于或小于).
(4)t3时若升高温度,则逆反应速率将 (填增大.减小或不变).
(5)t3时减小容器的体积,则正反应率 逆反应速率(填大于、等于或小于).
【答案】分析:(1)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
(2)根据v=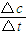 计算;
计算;
(3)从反应各物质的物质的量的变化趋势分析;
(4)从温度对反应速率的影响的角度分析;
(5)根据(1)判断出方程式,根据方程式中反应前后的计量数关系判断压强对平衡移动的影响.
解答:解:(1)由图象可以看出,反应中N的物质的量减少,应为反应物,M的物质的量增多,应为生成物,
当反应进行到2min时,△n(N)=6mol,△n(M)=3mol,
则△n(N):△n(M)=2:1,参加反应的物质的物质的量之比等于化学计量数之比,
则反应的方程式为:2N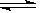 M,故答案为:2N
M,故答案为:2N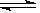 M;
M;
(2)反应开始至2min末,Z的反应速率为:v=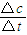 =
=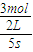 =0.3mol/(L?s),
=0.3mol/(L?s),
故答案为:0.3mol/(L?s);
(3)t2时,反应没有达到平衡状态,此时反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,反应向正反应方向移动,则正反应速率大于逆反应速率,故答案为:大于;
(4)升高温度,正逆反应速率都增大,故答案为:增大;
(5)反应的方程式为:2N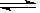 M,由方程式可以看出,t3时减小容器的体积,平衡向正反应方向移动,则正反应速率大于逆反应速率,故答案为:大于.
M,由方程式可以看出,t3时减小容器的体积,平衡向正反应方向移动,则正反应速率大于逆反应速率,故答案为:大于.
点评:本题考查化学平衡图象题目,题目难度不大,注意分析图象中各物理量的变化曲线,把握外界条件对平衡移动以及反应速率的影响为解答该题的关键.
(2)根据v=
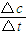 计算;
计算;(3)从反应各物质的物质的量的变化趋势分析;
(4)从温度对反应速率的影响的角度分析;
(5)根据(1)判断出方程式,根据方程式中反应前后的计量数关系判断压强对平衡移动的影响.
解答:解:(1)由图象可以看出,反应中N的物质的量减少,应为反应物,M的物质的量增多,应为生成物,
当反应进行到2min时,△n(N)=6mol,△n(M)=3mol,
则△n(N):△n(M)=2:1,参加反应的物质的物质的量之比等于化学计量数之比,
则反应的方程式为:2N
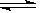 M,故答案为:2N
M,故答案为:2N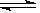 M;
M;(2)反应开始至2min末,Z的反应速率为:v=
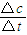 =
=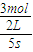 =0.3mol/(L?s),
=0.3mol/(L?s),故答案为:0.3mol/(L?s);
(3)t2时,反应没有达到平衡状态,此时反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,反应向正反应方向移动,则正反应速率大于逆反应速率,故答案为:大于;
(4)升高温度,正逆反应速率都增大,故答案为:增大;
(5)反应的方程式为:2N
 M,由方程式可以看出,t3时减小容器的体积,平衡向正反应方向移动,则正反应速率大于逆反应速率,故答案为:大于.
M,由方程式可以看出,t3时减小容器的体积,平衡向正反应方向移动,则正反应速率大于逆反应速率,故答案为:大于.点评:本题考查化学平衡图象题目,题目难度不大,注意分析图象中各物理量的变化曲线,把握外界条件对平衡移动以及反应速率的影响为解答该题的关键.

练习册系列答案
相关题目
在一定温度下,在容积为10L的密闭容器中,用2molCO和10molH2O(气)相互混合并加热到800℃时,有下列平衡:CO+H2O?CO2+H2,且平衡常数K=1,则有CO的转化率为( )
| A、16.7% | B、50% | C、66.7% | D、83.3% |
 在一定温度下,在容积为2L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题:
在一定温度下,在容积为2L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题: M
M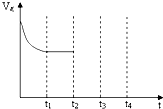 目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.