题目内容
 目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.已知:N2(g)+O2(g)═2NO(g);△H=+180.5kJ/mo1
2C(s)+O2(g)═2CO(g);△H=-221.0kJ/mo1
C(s)+O2(g)═CO2(g);△H=-393.5kJ/mo1
(1)汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是
(2)汽车尾气中转化器中发生的反应:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=
(3)在一定温度下,在体积2L的密闭容器中充入0.8mol NO和0.7mol CO,5s达到平衡状态,此时容器中N2的体积分数为0.25.
①达到平衡时N2平均反应速率v(N2)=
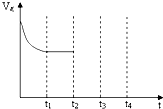
②如图,在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态.请在图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
(4)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采取的措施是
A.降低温度 B.增大压强同时加催化剂
C.升高温度同时充入N2 D.及时将CO2和N2从反应体系中移走.
分析:(1)根据温度对化学平衡的影响进行判断;根据△G=△H-T?△S进行判断,如△G<0,则反应能自发进行,如△G>0,则不能自发进行;
(2)依据盖斯定律结合热化学方程式计算出该反应的焓变;
(3)①设出氮气在平衡时的物质的量,然后利用三段式及氮气的体积分数计算出氮气的物质的量,再根据反应速率表达式计算出氮气的平均反应速率、根据平衡常数表达式计算出该反应在该温度下的平衡常数;该反应为放热反应,升高温度后平衡向着逆向移动,平衡常数减小;
②增大容器体积,减小了压强,正逆反应速率减小,平衡向着气体体积增大的方向移动,据此画出从t2到t4时刻正反应速率随时间的变化曲线;
(4)根据影响化学反应速率、化学平衡的因素进行判断.
(2)依据盖斯定律结合热化学方程式计算出该反应的焓变;
(3)①设出氮气在平衡时的物质的量,然后利用三段式及氮气的体积分数计算出氮气的物质的量,再根据反应速率表达式计算出氮气的平均反应速率、根据平衡常数表达式计算出该反应在该温度下的平衡常数;该反应为放热反应,升高温度后平衡向着逆向移动,平衡常数减小;
②增大容器体积,减小了压强,正逆反应速率减小,平衡向着气体体积增大的方向移动,据此画出从t2到t4时刻正反应速率随时间的变化曲线;
(4)根据影响化学反应速率、化学平衡的因素进行判断.
解答:解:(1)由于升高温度,反应速率加快,平衡朝生成NO的方向移动,会导致单位时间内NO排放量越大;由于反应2CO(g)═2C(s)+O2(g)中△H>0,△S<0,在任何情况下都不能自发进行,
故答案为:升高温度,反应速率加快,平衡朝生成NO的方向移动;不可行,因为△H>0,△S<0,在任何情况下都不能自发进行;
(2)①N2(g)+O2(g)═2NO(g);△H=+180.5kJ/mo1
②2C(s)+O2(g)═2CO(g);△H=-221.0kJ/mo1
③C(s)+O2(g)═CO2(g);△H=-393.5kJ/mo1
根据盖斯定律可得:③×2-①-②,2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ?mol-1,
故答案为:-746.5 kJ?mol-1;
(3)①设达到平衡时氮气的物质的量为xmol,则
2NO(g)+2CO(g)=N2(g)+2CO2(g)
反应前(mol)0.8 0.7 0 0
变化(mol) 2x 2x x 2x
平衡(mol)0.8-2x 0.7-2x x 2x
达到平衡时氮气的体积分数为:
=0.25,
解得:x=0.3,
达到平衡时氮气的反应速率为:v(N2)=
=0.03mol?L-1?s?1;
达到平衡时各组分浓度为:c(CO)=
=0.05mol/L,c(NO)=
=0.1mol/L,c(N2)=
=0.15mol/L,c(CO2)=
=0.3mol/L,该温度下该反应的平衡常数为:K=
=540;
由于该反应为放热反应,升高温度后平衡向着逆向移动,该反应的平衡常数减小,
故答案为:0.03;540;减小;
②在t2时刻,将容器的容积迅速扩大到原来的2倍,则正逆反应速率均是减小的,但平衡向正反应方向一定,所以正确的图象应该是(见答案).在t2时刻,将容器的容积迅速扩大到原来的2倍,则正逆反应速率均是减小的,但平衡向逆反应方向移动,所以正确的图象应该是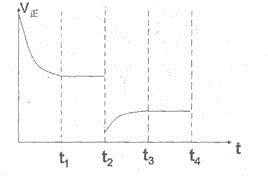 ,
,
故答案为:
(4)2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5 kJ?mol-1,
A.降低温度,反应速率会减小,无法通过反应速率,故A错误;
B.增大压强同时加催化剂,增大压强后,平衡向着正向移动,一氧化氮的转化率增大,且反应速率增大,使用催化剂,反应速率加快,故B正确;
C.升高温度同时充入N2,升高温度平衡向着逆向移动,一氧化氮的转化率减小,故C错误;
D.及时将CO2和N2从反应体系中移走,一氧化氮的转化率增大,但是反应速率减小,故D错误
故答案为:B.
故答案为:升高温度,反应速率加快,平衡朝生成NO的方向移动;不可行,因为△H>0,△S<0,在任何情况下都不能自发进行;
(2)①N2(g)+O2(g)═2NO(g);△H=+180.5kJ/mo1
②2C(s)+O2(g)═2CO(g);△H=-221.0kJ/mo1
③C(s)+O2(g)═CO2(g);△H=-393.5kJ/mo1
根据盖斯定律可得:③×2-①-②,2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ?mol-1,
故答案为:-746.5 kJ?mol-1;
(3)①设达到平衡时氮气的物质的量为xmol,则
2NO(g)+2CO(g)=N2(g)+2CO2(g)
反应前(mol)0.8 0.7 0 0
变化(mol) 2x 2x x 2x
平衡(mol)0.8-2x 0.7-2x x 2x
达到平衡时氮气的体积分数为:
| x |
| (0.8-2x)+(0.7-2x)+x+2x |
解得:x=0.3,
达到平衡时氮气的反应速率为:v(N2)=
| ||
| 5s |
达到平衡时各组分浓度为:c(CO)=
| (0.7-0.3×2)mol |
| 2L |
| (0.8-0.3×2)mol |
| 2L |
| 0.3mol |
| 2L |
| 0.3mol×2 |
| 2L |
| 0.15×0.32 |
| 0.052×0.12 |
由于该反应为放热反应,升高温度后平衡向着逆向移动,该反应的平衡常数减小,
故答案为:0.03;540;减小;
②在t2时刻,将容器的容积迅速扩大到原来的2倍,则正逆反应速率均是减小的,但平衡向正反应方向一定,所以正确的图象应该是(见答案).在t2时刻,将容器的容积迅速扩大到原来的2倍,则正逆反应速率均是减小的,但平衡向逆反应方向移动,所以正确的图象应该是
 ,
,故答案为:

(4)2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5 kJ?mol-1,
A.降低温度,反应速率会减小,无法通过反应速率,故A错误;
B.增大压强同时加催化剂,增大压强后,平衡向着正向移动,一氧化氮的转化率增大,且反应速率增大,使用催化剂,反应速率加快,故B正确;
C.升高温度同时充入N2,升高温度平衡向着逆向移动,一氧化氮的转化率减小,故C错误;
D.及时将CO2和N2从反应体系中移走,一氧化氮的转化率增大,但是反应速率减小,故D错误
故答案为:B.
点评:本题考查了化学平衡的建立过程、化学平衡的影响因素、有关化学平衡常数的计算等知识,题目难度较大,注意掌握化学平衡的影响因素,明确化学平衡常数的概念及计算方法.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目