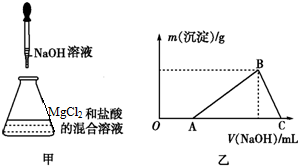
题目内容
20.写出下列电解质在水溶液中的电离方程式NaHCO3NaHCO3=Na++HCO3-
HClHCl=H++Cl-
CH3COOHCH3COOH?CH3COO-+H+
Fe(OH)3Fe(OH)3?Fe3++3OH-.
分析 碳酸氢钠为强电解质,在溶液中完全电离出钠离子和碳酸氢根离子;
氯化氢为强电解质,在溶液中完全电离出氢离子和氯离子;
醋酸为弱酸,在溶液中部分电离出氢离子,电离方程式用可逆号;
氢氧化铁为弱碱,电离方程式用可逆号,书写时不需要分步书写.
解答 解:碳酸氢钠在溶液中完全电离,其电离方程式为:NaHCO3=Na++HCO3-;
氯化氢在溶液中完全电离出氢离子和氯离子,其电离方程式为:HCl=H++Cl-;
醋酸为弱电解质,在溶液中存在电离平衡,醋酸的电离方程式为:CH3COOH?CH3COO-+H+;
氢氧化铁在溶液中存在电离平衡,其电离方程式为:Fe(OH)3?Fe3++3OH-,
故答案为:NaHCO3=Na++HCO3-;HCl=H++Cl-;CH3COOH?CH3COO-+H+;Fe(OH)3?Fe3++3OH-.
点评 本题考查了电离方程式的书写,题目难度中等,明确电离方程式的书写原则为解答关键,注意掌握弱酸、弱碱的电离方程式的区别,试题培养了学生的灵活应用能力.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
10.在一定条件下,科学家利用从烟道气中分离出的CO2与太阳能电池电解水产生的H2合成甲醇,其过程如图所示,试回答下列问题:
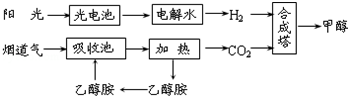
(1)该合成路线对于环境保护的价值在于减少烟道气中二氧化碳排放到空气中造成温室效应.
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-;.
(3)CH3OH(l)、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9KJ/mol.
(4)据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇也已成为现实.
2CO2(g)+6H2(g),CH3CH2OH(g)+3H2O(g);下列叙述正确的是acd.
a.使用催化剂可能大大提高生产效率
b.反应需在300℃进行可推测该反应是吸热反应
c.充入过量CO2气体可提高H2的转化率
d.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
(5)在一定体积的密闭容器中,CO2和H2也可以进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
其化学平衡常数K和温度T的关系如表所示:
回答下列问题:
①该反应为吸热反应(填“吸热”或“放热”).
②能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变 B.混合气体中c(CO)不变 C.v(H2)正=v(H2O)逆
D.c(CO)=c(H2) E.混合气体的密度保持不变 F.混合气体的平均相对分子质量保持不变
③在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L,c(H2)为 1.5mol/L,c(CO) 为 1mol/L,c(H2O) 为 3mol/L,则下一时刻,反应向逆向移动(填“正向”“逆向”或“不”).

(1)该合成路线对于环境保护的价值在于减少烟道气中二氧化碳排放到空气中造成温室效应.
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-;.
(3)CH3OH(l)、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9KJ/mol.
(4)据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇也已成为现实.
2CO2(g)+6H2(g),CH3CH2OH(g)+3H2O(g);下列叙述正确的是acd.
a.使用催化剂可能大大提高生产效率
b.反应需在300℃进行可推测该反应是吸热反应
c.充入过量CO2气体可提高H2的转化率
d.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
(5)在一定体积的密闭容器中,CO2和H2也可以进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
其化学平衡常数K和温度T的关系如表所示:
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应为吸热反应(填“吸热”或“放热”).
②能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变 B.混合气体中c(CO)不变 C.v(H2)正=v(H2O)逆
D.c(CO)=c(H2) E.混合气体的密度保持不变 F.混合气体的平均相对分子质量保持不变
③在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L,c(H2)为 1.5mol/L,c(CO) 为 1mol/L,c(H2O) 为 3mol/L,则下一时刻,反应向逆向移动(填“正向”“逆向”或“不”).
11.下列物质中锰元素的化合价最高的是( )
| A. | MnO2 | B. | MnCl2 | C. | K2MnO4 | D. | KMnO4 |
8.为实现下列实验目的,依据下表提供的主要仪器、所用试剂合理的( )
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离Br2和CCl4的混合物 | 分液漏斗、烧杯 | Br2和CCl4的混合物、蒸馏水 |
| B | 制备Fe(OH)3胶体 | 烧杯、玻璃棒 | 饱和Na2CO3溶液、0.5mol/L FeCl3溶液 |
| C | 实验室制取NH3 | 试管、带导管的橡皮塞 | 浓氨水、生石灰 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、 0.100 0 mol/L盐酸、酚酞溶液 |
| A. | A | B. | B | C. | C | D. | D |
5.下列物质符合如图阴影部分的要求,且其在水溶液中的电离方程式书写正确的是( )
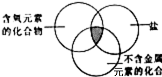

| A. | K2CO3═2K++CO32- | B. | NH4NO3═NH4++NO3- | ||
| C. | H2SO4═2H++SO42- | D. | NH4ClO3═NH4++Cl5++3O2- |
12.等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为3:4,则甲、乙两烧杯中的反应情况可能分别是( )
| A. | 甲、乙中都是铝过量 | B. | 甲中铝过量,乙中碱过量 | ||
| C. | 甲中酸过量,乙中铝过量 | D. | 甲、乙中都是铝不足 |
9.物质的量浓度相同的下列物质的水溶液,H+浓度最小的是( )
| A. | Na2C03 | B. | HCl | C. | Na2S04 | D. | KN03 |