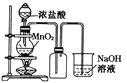
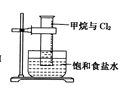
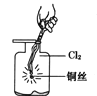
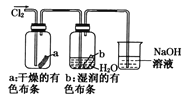
题目内容
【题目】在一固定容积的密闭容器中,保持一定温度,在一定条件下进行如下反应A(g)+2B(g)![]() 3C(g),已知起始时加入2 mol A(g)和3 mol B(g),达平衡后,生成a mol C(g)。此时,C(g)在反应混合气体中的体积分数为_____________(用含字母a的代数式表示)。
3C(g),已知起始时加入2 mol A(g)和3 mol B(g),达平衡后,生成a mol C(g)。此时,C(g)在反应混合气体中的体积分数为_____________(用含字母a的代数式表示)。
(1)相同实验条件下,若在同一容器中改为开始加入1 mol A和1.5mol B,达平衡时C的物质的量为________mol(用含字母a的代数式表示)。此时C在反应混合物中的体积分数_____________(填“增大”、“减小”或“不变”)。
(2)相同实验条件下,若在同一容器中改为开始时加入2 mol A和2 mol B,达平衡时,要求C在混合物中体积分数与(1)相同,则开始时还需加入_________mol C,平衡时C的物质的量为_______________mol(用含字母a的代数式表示)。
【答案】a/5a/2不变62a
【解析】
(1)先利用反应前后气体体积不变,求出平衡时混合气体的总的物质的量,再根据体积分数定义计算;
(2)恒温恒容,反应前后气体体积不变,对应物质按相同的比例加入,平衡等效,物质的转化率相同,平衡时对应组分的含量相同;
(3)体积分数仍与原平衡相同,说明为等效平衡,恒温恒容,反应前后气体体积不变,按化学计量数转化到左边,A、B的物质的量之比满足2:3,则与原平衡等效。
(1)反应前后气体体积不变,所以平衡时混合气体的总的物质的量为2mol+3mol=5mol,所以平衡时,C在反应混合气中的体积分数为![]() =
=![]() 。
。
因此,本题正确答案是:a/5;
(2)恒温恒容,反应前后气体体积不变,加入1 mol A和1.5mol B,A、B的物质的量之比为2:3,与原平衡相同,为等效平衡,物质的转化率相同,平衡时对应组分的含量相同,C在反应混合气中的体积分数不变,C的物质的量变为![]() mol。
mol。
因此,本题正确答案是:![]() ;不变;
;不变;
(3)恒温恒容,反应前后气体体积不变,按化学计量数转化到左边,A、B的物质的量之比满足2:3,令加入nmolC,则: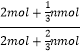 =
=![]() ,计算得出n=6。按化学计量数转化到左边,起始量等效于加入4 mol A和6mol B,则平衡时C的物质的量为2a mol,
,计算得出n=6。按化学计量数转化到左边,起始量等效于加入4 mol A和6mol B,则平衡时C的物质的量为2a mol,
因此,本题正确答案是:6;2a。

【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
【题目】(1)已知:CH4(g)+4NO2( g)=4NO(g)+CO2(g)+2H2O(g) △H= -574 kJ·mol-l;CH4(g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g) △H=-1160 kJ·mol-1,该条件下CH4(g)还原NO2(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式:__________。
(2)已知在448 ℃时,反应H2(g)+I2(g) ![]() 2HI(g)的平衡常数K1为49,则该温度下反应反应
2HI(g)的平衡常数K1为49,则该温度下反应反应![]() H2(g)+
H2(g)+![]() I2(g)
I2(g) ![]() HI(g)的平衡常数K3为___________________________。
HI(g)的平衡常数K3为___________________________。
(3)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①)该反应的化学平衡常数表达式为K=________。
②该反应为________(填“吸热”或“放热”)反应。
③能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变 C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
④某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。
⑤在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应将________(填“正向”或“逆向”)进行。