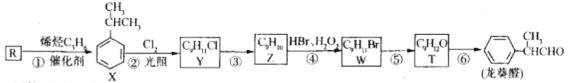
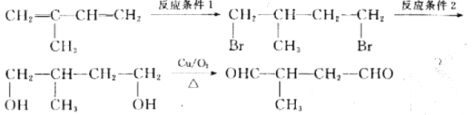
题目内容
【题目】25℃时,关于pH = 2的盐酸,下列说法不正确的是
A. 溶液中c(H+) = 1.0ⅹ10-2 mol/L
B. 加水稀释100倍后,溶液的pH = 4
C. 加入等体积pH = 12的氨水,溶液呈碱性
D. 此溶液中由水电离出的c(OH-) = 1.0ⅹ10-2 mol/L
【答案】D
【解析】
A、根据pH=-lgc(H+),其中c(H+)表示溶液中c(H+),即常温下,pH=2的盐酸溶液中c(H+)=1.0×10-2mol·L-1,故A说法正确;
B、稀释前后溶质的物质的量不变,假设稀释前溶液的体积为1L,稀释100倍后,溶液中c(H+)=![]() =1×10-4mol·L-1,即pH=4,故B说法正确;
=1×10-4mol·L-1,即pH=4,故B说法正确;
C、NH3·H2O为弱碱,因此pH=12的氨水中c(NH3·H2O)大于pH=2的盐酸中c(HCl),等体积混合后,NH3·H2O过量,混合后溶液显碱性,故C说法正确;
D、酸溶液中OH-全部来自水电离,根据水的离子积,pH=2的盐酸中c(OH-)=![]() =10-12mol·L-1,故D说法错误;
=10-12mol·L-1,故D说法错误;
答案选D。

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目