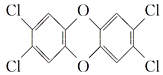
题目内容
【题目】下列物质有关性质与应用的对应关系不正确的是
选项 | 化学性质 | 实际应用 |
A | ClO2具有强氧化性 | 用于自来水的消毒杀菌 |
B | Na2O2与CO2和H2O均能发生反应 | 用作呼吸面具供氧剂 |
C | 钠的金属性比钾弱 | Na与KCl反应制取单质钾 |
D | FeCl3溶液能与Cu反应 | 用FeCl3溶液蚀刻印刷电路板 |
A. A B. B C. C D. D
【答案】C
【解析】
A项,二氧化氯中氯的化合价为+4,具有强氧化性,可以用于自来水的杀菌消毒,故A项正确;
B项,Na2O2与CO2和H2O均能发生反应放出氧气,所以用作呼吸面具供氧剂,故B项正确;
C项,工业上制取钾用钠置换钾,其原因是Na+KCl![]() NaCl+K是可逆反应,而K的熔、沸点比Na低,产生钾蒸气,使平衡向右移动,与还原性大小无关,故C项错误;
NaCl+K是可逆反应,而K的熔、沸点比Na低,产生钾蒸气,使平衡向右移动,与还原性大小无关,故C项错误;
D项,FeCl3溶液与铜能发生反应2FeCl3+Cu═2FeCl2+CuCl2,所以可用FeCl3溶液蚀刻印刷电路板,故D项正确。
故答案选C。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】已知硫酸、氨水的密度与所加水量的关系如下图所示:

现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶液 | 溶质的物质的量浓度 | 溶液的密度/g·cm-3 |
硫酸 | 4 mol·L-1 | ρ1 |
2 mol·L-1 | ρ2 | |
氨水 | 4 mol·L-1 | ρ3 |
2 mol·L-1 | ρ4 |
(1)ρ1、ρ2、ρ3、ρ4由大到小的顺序为:________。
(2)表中2 mol·L-1氨水的质量分数为:________。
(3)将4 mol·L-1的氨水与2 mol·L-1的硫酸等体积混合,所得溶液呈______性(填“酸”、“碱”、“中”);溶液中离子浓度从大到小的顺序是:___________________。
(4)将20%的硫酸与10%的硫酸等体积混合,所得硫酸溶液的质量分数是______。
A.>15% B.=15% C.<15% D.无法判断
(5)100g浓度为4 mol·L-1的硫酸溶液与_____mL水混合,可以使硫酸的物质的量浓度减小到2 mol·L-1。