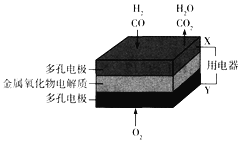
题目内容
【题目】某温度下,在一个2L的密闭容器中,加人4molA和2molB进行如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
A.该反应的化学平衡常数表达式是K=![]()
B.此时,B的平衡转化率是35%
C. 增加C,B的平衡转化率不变
D.增大该体系的压强,平衡向右移动,化学平衡常数增大
【答案】C
【解析】
试题分析:根据化学方程式,生成1.6molC的同时消耗0.8molB、1.2molA,生成0.8molD,反应的前后压强之比为5:4,即物质的量之比是5:4,说明反应后气体的总物质的量是4×(4mol+2mol)/5=4.8mol,A、B剩余的物质的量是4-1.2+2-0.8=4mol,根据生成C、D的物质的量,所以4.8mol-4mol=0.8mol,则D是气体,而C是非气体。A、所以该反应的平衡常数的表达式中不能有C的存在,错误;B、消耗B的物质的量是0.8mol,则B的转化率是0.8mol/2mol×100%=40%,错误;C、C是非气体,所以增加C的量对平衡无影响,正确;D、增大该体系的压强,平衡向右移动,化学平衡常数不变,错误,答案选C。

练习册系列答案
相关题目
【题目】下列给出的各组物质,不能完成下列转化的是( ) 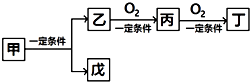
物质 | 甲 | 乙 | 丙 | 丁 | 戊 |
A | C6H12O6 | CH3CH2OH | CH3CHO | CH3COOH | CO2 |
B | NH4Cl | NH3 | N2 | NO2 | HCl |
C | NaCl | Na | Na2O | Na2O2 | Cl2 |
D | CH4 | C | CO | CO2 | H2 |
A.A
B.B
C.C
D.D