题目内容
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示. 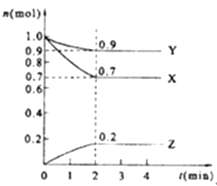
(1)由图中所给数据进行分析,该反应的化学方程式为;
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=;
(3)2min反应达平衡容器内混合气体的平均相对分子质量比起始时(填增大、减小或不变);混合气体密度比起始时(填增大、减小或不变).
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n (X)=n (Y)=n (Z),则原混合气体中a:b= .
(5)下列措施能加快反应速率的是 .
A.恒压时充入He
B.恒容时充入He
C.恒容时充入X
D.及时分离出Z
E.升高温度
F.选择高效的催化剂
(6)下列说法正确的是 .
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关
D.化学反应的限度是不可能改变的
E.增大Y的浓度,正反应速率加快,逆反应速率减慢.
【答案】
(1)3X+Y?2Z
(2)0.05mol/(L?min)
(3)增大;不变
(4)5:3
(5)CEF
(6)AC
【解析】解:(1.)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y2Z,所以答案是:3X+Y2Z;
(2.)在2min时间内,用Z表示反应的平均速率v(Z)= ![]() =
= ![]() =0.05mol/(Lmin),所以答案是:0.05mol/(Lmin);
=0.05mol/(Lmin),所以答案是:0.05mol/(Lmin);
(3.)混合气体的平均相对分子质量M= ![]() ,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,混合气体密度ρ=
,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,混合气体密度ρ= ![]() ,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,所以答案是:增大;不变;
,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,所以答案是:增大;不变;
(4.)3X+Y2Z(设Y的变化量是x)
3X | + | Y | 2Z | (设Y的变化量是x) | ||
初始量: | a | b | 0 | |||
变化量: | 3x | x | 2x | |||
平衡量: | a﹣3x | b﹣x | 2x |
当n (X)=n (Y)=n (Z)时,a﹣3x=b﹣x=2x,则a=5x,b=3x,所以原混合气体中a:b=5:3,
所以答案是:5:3;
(5.)A.恒压时充入He,体系分压减小,反应速率减小,故错误;
B.恒容时充入He,不影响体系压强和浓度,反应速率不变,故错误;
C.恒容时充入X,X的浓度增大,反应速率加快,故正确;
D.及时分离出Z,浓度不增加,压强减小,平衡右移,反应速率不加快,故错误;
E.升高温度,任何化学反应速率加快,故正确;
F.选择高效的催化剂,反应速率加快,故正确,
所以答案是:CEF;
(6.)A.反应伴随能量变化,升高温度改变化学反应的限度,故正确;
B.升高温度正逆反应速率均加快,故错误;
C.化学反应的限度与反应物性质和外部因素有关,与时间长短无关,故正确;
D.化学反应的限度与反应物性质和外部因素有关,是可能改变的,故错误;
E.增大Y的浓度,正反应速率加快,逆反应速率同时加快,故错误,所以答案是:AC.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案【题目】甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示,下列各组物质中不能按图示关系转化的是
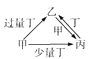
选项 | 甲 | 乙 | 丙 | 丁 |
A | Ca(OH)2 | Ca(HCO3)2 | CaCO3 | CO2 |
B | FeCl3 | Fe | FeCl2 | Zn |
C | Fe | Fe(NO3)2 | Fe(NO3)3 | HNO3 |
D | SO2 | Na2SO3 | NaHSO3 | NaOH |
A. A B. B C. C D. D
【题目】下列对实验的解释或结论正确的是
选项 | 实验 | 解释或结论 |
A | 用无锈铁丝蘸取某溶液进行焰色 反应,火焰呈黄色 | 该溶液中一定含有Na+,一定不含K+ |
B | 将硫酸酸化的H2O2溶液滴入FeSO4溶液中,溶液变黄色 | H2O2的氧化性比Fe3+强 |
C | 将溴水滴入苯中,振荡后下层几乎无色 | 溴与苯发生加成反应 |
D | 向盛有冷水的烧杯中滴加FeCl3稀溶液并煮沸 | 制备Fe(OH)3胶体 |
A. A B. B C. C D. D