题目内容
(附加题2)为测定一种复合型氧化物的磁性粉末材料的组成,称取12.52 g该样品,将其全部溶解于过量的稀硝酸后配成100 mL溶液。取其一半,加入过量的K2SO4溶液,生成了白色沉淀,经过滤、洗涤、烘干后得4.66 g 固体。向余下的50 mL溶液中加入少许KSCN溶液,显红色;加入过量的NaOH溶液时则生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20 g固体。
(1)计算磁性粉末中氧元素的质量分数_____________________;
(2)确定该材料的化学式__________________________________。
(提示:三价铁盐与KSCN反应显红色)
(1)计算磁性粉末中氧元素的质量分数_____________________;
(2)确定该材料的化学式__________________________________。
(提示:三价铁盐与KSCN反应显红色)
(1)20.45%;(3分) (2)BaFe2O4(或BaO·Fe2O3)
(1)依据题意可知,4.66g沉淀是硫酸钡,物质的量是
3.20 g固体是氧化铁,物质的量是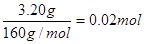
因此12.52g样品中氧元素的质量是12.52g-(0.02mol×137g/mol-0.02mol×2×56g/mol)×2=2.56g
所以氧原子的物质的量是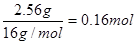
其氧元素的质量分数是
(2)样品中Ba、Fe、O原子的个数之比是0.02×2︰0.02×2×2︰0.16=1︰2︰4
所以化学式为BaFe2O4(或BaO·Fe2O3)。

3.20 g固体是氧化铁,物质的量是
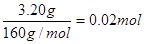
因此12.52g样品中氧元素的质量是12.52g-(0.02mol×137g/mol-0.02mol×2×56g/mol)×2=2.56g
所以氧原子的物质的量是
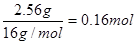
其氧元素的质量分数是

(2)样品中Ba、Fe、O原子的个数之比是0.02×2︰0.02×2×2︰0.16=1︰2︰4
所以化学式为BaFe2O4(或BaO·Fe2O3)。

练习册系列答案
相关题目
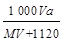
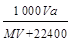
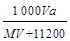
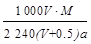
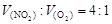 ]。然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为( )
]。然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为( )