题目内容
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A.常温常压下,1mol甲基所含的电子总数为10nA |
| B.14g乙烯和丙烯的混合气体中含有的碳原子数为nA |
| C.标准状况下,2.24 L苯中含有0.3 nA个碳碳双键 |
| D.常温常压下,1L 0.1mol·L-1 KMnO4与足量的FeSO4反应转移电子数为3nA |
B
解析试题分析:甲基由碳原子和氢原子构成,则1个-CH3所含电子数等于碳、氢原子所含电子数的总和,即6+3=9,1mol甲基含有9mol电子,故A错;乙烯和丙烯的含碳量都是6/7,则混合气体所含碳原子的质量为12g,12g碳原子的物质的量为1mol,故B正确;苯是液体,不能2.24L除以22.4L/mol求其物质的量,且苯分子中只有介于碳碳单键和碳碳双键之间的独特的键,不含碳碳双键,故C错;高锰酸钾的物质的量为0.1mol,完全被硫酸亚铁还原为MnSO4,锰元素的化合价由+7价降为+2价,则1个高锰酸钾得到5个电子,所以0.1mol高锰酸钾得到0.5mol电子,故D错。
考点:考查阿伏加德罗常数,涉及质量、摩尔质量、物质的量、物质的组成、物质的结构、溶液体积、物质的量浓度、气体体积、气体摩尔体积、物质的量、氧化还原反应转移电子数、物质的量在化学方程式中的应用等。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
设NA为阿伏加德罗常数的值。下列说法一定正确的是
| A.25℃,pH=13的NaOH溶液中含有OH-为0.1 NA |
| B.1 L 0.1 mol·L-1 CuSO4溶液中含有Cu2+为0.1 NA |
| C.2.24LN2和NH3混合气体中原子间含有的共用电子对数目为0.3NA |
| D.2molSO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
下列化学用语书写正确的是
A.NaHS水解反应:HS-+ H2O H3O++ S2- H3O++ S2- |
B.用两个铜片作电极电解盐酸的初始阶段:Cu+2H+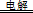 H2↑+Cu2+ H2↑+Cu2+ |
| C.Fe3O4与稀硝酸反应:Fe3O4+8H+ = Fe2++2Fe3++4H2O |
| D.碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.1L0.1mol·L-1NaHSO3溶液中含有H+的数目为NA个 |
| B.常温常压下,等质量的CO2和N2O的气体体积相等 |
| C.60g组成为C2H4O2的有机物含C-H键数目为3NA个 |
| D.向稀HNO3溶液中加入过量的铁粉经充分反应后,转移的电子数目为3NA个 |
下列有关化学用语表示正确的是
| A.Mg2+的电子排布式:1s22s22p63s2 |
B.铁的原子结构示意图: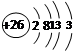 |
C.Na2S的电子式: 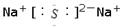 |
| D.次氯酸的结构式:H-Cl-O |
设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.1 molCH4分子中共价键总数为NA |
| B.水的摩尔质量就是NA个水分子的质量之和 |
| C.含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L |
| D.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |
下列说法不正确的是(设NA为阿伏加德罗常数的数值)( )
| A.20g重水含有10NA个电子 |
| B.1L 0.1 mol·L-1 Na2SO3溶液中含有的SO32-数目少于0.1NA个 |
| C.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高 |
| D.用足量铜粉除去FeCl2溶液中的FeCl3杂质 |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA |
| B.1 mol乙烷分子含有8NA个共价键 |
| C.58.5 g的氯化钠固体中含有NA个氯化钠分子 |
| D.在0.1 mol过氧化钠固体中,阴离子总数等于0.1 NA |