题目内容
18.从下列材料中选择几种组成原电池,下列组合合理的是( )①番茄②碳棒③导线④镁棒⑤铜棒⑥稀硫酸⑦烧杯.
| A. | ①②③ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ⑤⑥⑦ |
分析 原电池的形成条件:
1、有两种活泼性不同的金属(或其中一种为非金属导体)作电极;
3、电极均插入电解质溶液中;
3、两极相互连接(或接触);
4、能自发的发生氧化还原反应.
解答 解:A、①番茄②碳棒③导线,不存在两种活泼性不同的金属(或其中一种为非金属导体)作电极条件,不能形成原电池,故A错误;
B、②碳棒③导线④镁棒⑤铜棒,没有电解质溶液,不能形成原电池,故B错误;
C、①番茄③导线④镁棒⑤铜棒,番茄具有酸性能够与镁反应,符合原电池的构成条件,故C正确;
D、⑤铜棒⑥稀硫酸⑦烧杯,不存在两种活泼性不同的金属(或其中一种为非金属导体)作电极条件,不能形成原电池,故D错误;
故选C.
点评 本题考查了原电池的形成条件,难度不大,学生应学会根据原电池的形成条件来解答即可.

练习册系列答案
相关题目
8.(1)与铜同周期、基态原子最外层电子数相同的过渡元素,它位于周期表中d区,其基态原子的电子排布式为[Ar]3d54s1.
(2)如图1曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系.其中A点表示的单质是F2(填化学式).
(3)三氟化硼分子的空间构型是平面三角形;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B-X键都当作单键考虑来计算键长,理论值与实测键长结果如表.硼卤键长实测值比计算值要短得多,可能的原因是B与X原子间还有π键形成.
(4)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图2.
①磷原子的杂化类型为sp3.
②这种多聚磷酸钠的化学式为Nan+1PnO3n+1.
(5)已知HF与F-通过氢键结合成HF2-.判断HF2-和HF2-微粒间能否形成氢键,并说明理由.在HF2-中,已经存在分子内氢键(F-H…F-),所以没有可用于形成分子间氢键的氢原子,故HF2-和HF2-微粒间不能形成氢键.
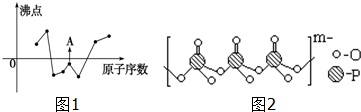
(2)如图1曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系.其中A点表示的单质是F2(填化学式).
| 键长/(pm) | B-F | B-Cl | B-Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
(4)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图2.
①磷原子的杂化类型为sp3.
②这种多聚磷酸钠的化学式为Nan+1PnO3n+1.
(5)已知HF与F-通过氢键结合成HF2-.判断HF2-和HF2-微粒间能否形成氢键,并说明理由.在HF2-中,已经存在分子内氢键(F-H…F-),所以没有可用于形成分子间氢键的氢原子,故HF2-和HF2-微粒间不能形成氢键.

6.下列关于苯的说法中,正确的是( )
| A. | 试管中加入少量苯,加入溴水振荡后,溴水褪色,发生了加成反应 | |
| B. | 苯能使酸性高锰酸钾溶液褪色 | |
| C. | 苯较难发生加成反应,所以通常要加入催化剂 | |
| D. | 苯不能发生取代反应 |
13.以硼镁矿( 2MgO.B2O3.H2O、SiO2及少量Fe3O4、CaCO3、Al2O3 )为原料生产硼酸的工艺流程如下:

已知:表一:不同温度下H3BO3的溶解度
表二:不同物质沉淀完全时的pH
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为应分批加入H2SO4 .
(2)“浸出液”显酸性,含有H3BO3、Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质.“除杂”时,向浸出液中依次加入适量目H2O2和MgO,可以除去的杂质离子为Fe3+、Fe2+、Al3+,的作用为H2O2+2H++2Fe2+=2Fe3++2H2O(用离子方程式表示).
(3)“浸取”后,采用“热过滤”的目的为防止温度下降时H3BO3从溶液中析出.
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高.为了从“母液”中充分回收 MgSO4.H2O,应采取的措施是将“母液”蒸发浓缩,加压升温结晶.

(5)已知25℃时,硼酸( H3BO3)溶液中存在如下平衡:HBO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq) K=5.7×10-10;25℃时,0.7mol.L-1硼酸溶液中c(H)+≈2×10-5mol.L-1
(6)已知25℃时:
下列说法正确的是BD(填选项字母).
A.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
C.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
D.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者.

已知:表一:不同温度下H3BO3的溶解度
| 温度℃) | 20 | 40 | 60 | 100 |
| 溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 9.7 | 12.4 |
(2)“浸出液”显酸性,含有H3BO3、Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质.“除杂”时,向浸出液中依次加入适量目H2O2和MgO,可以除去的杂质离子为Fe3+、Fe2+、Al3+,的作用为H2O2+2H++2Fe2+=2Fe3++2H2O(用离子方程式表示).
(3)“浸取”后,采用“热过滤”的目的为防止温度下降时H3BO3从溶液中析出.
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高.为了从“母液”中充分回收 MgSO4.H2O,应采取的措施是将“母液”蒸发浓缩,加压升温结晶.

(5)已知25℃时,硼酸( H3BO3)溶液中存在如下平衡:HBO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq) K=5.7×10-10;25℃时,0.7mol.L-1硼酸溶液中c(H)+≈2×10-5mol.L-1
(6)已知25℃时:
| 化学式 | H2CO3 | CH3COOH |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
A.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
C.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
D.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者.
3.分子式为C6H12O2且与NaHCO3反应放出CO2的有机化合物有(不考虑立体结构)( )
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
7.相同条件下,用下列物质做氧化剂收集相同Cl2消耗浓盐酸最多的是( )
| A. | MnO2 | B. | KMnO4 | C. | NaClO | D. | KClO3 |
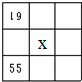
8.某种合金的晶胞结构如图所示,则下列说法正确的是( )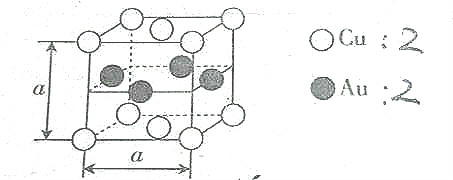

| A. | 该合金属于离子晶体 | B. | 该合金中Au的配位数是4 | ||
| C. | 该合金中Cu的配位数是8, | D. | 该合金的硬度低于Cu |

 (1)图为常见仪器的部分结构(有的仪器被放大)
(1)图为常见仪器的部分结构(有的仪器被放大)