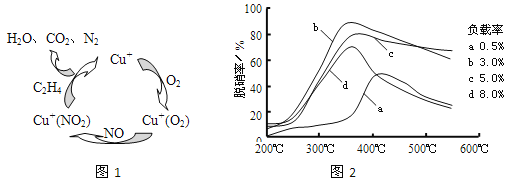
题目内容
【题目】下图为利用肼(N2H4)一空气燃料电池电解硫酸铜溶液的示意图。下列说法正确的是( )

A. 左图中离子交换膜为阳离子交换膜
B. 左图负极反应式为:N2H4-6e-+4OH-=N2↑+4H2O
C. 闭合开关K一段时间后,左图电池中电解质溶液的pH不变
D. 当右图阴极上析出4.48L气体(标准状况)时,消耗0.15molN2H4
【答案】D
【解析】该原电池中,正极上生成氢氧根离子,所以离子交换膜要选取阴离子交换膜, A错误;通入燃料的电极为负极,负极上N2H4失电子发生氧化反应,电极反应式为: N2H4-4e-+4OH-=N2↑+4H2O , B错误;闭合开关K一段时间后,左图电池中负极极反应为:N2H4-4e-+4OH-=N2↑+4H2O,正极极反应:O2+2H2O+4e-=4OH-,反应前后氢氧化钾溶质的量不变,但是反应发生后,有水生成,溶液体积变大,氢氧根离子浓度变小,pH减小,C错误;右图装置为电解池,碳棒为阳极,铜棒为阴极,电解硫酸铜溶液,阴极极反应①:Cu2++2e-=Cu铜离子的总量为0.2×0.5=0.1 mol,转移电子0.2 mol;②:2H++2e-=H2↑当生成氢气为4.48/22.4=0.2mol,转移电子为0.4 mol, 阴极极反应共转移电子0.6mol,根据串联电路电子转移总数相等规律,根据原电池负极极反应:N2H4-4e-+4OH-=N2↑+4H2O可知,消耗N2H4的量为0.15 mol,D正确;正确选项D。

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目