题目内容
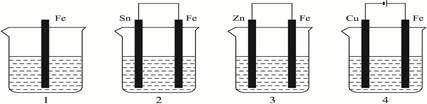
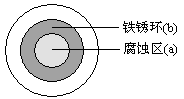
右图实验为研究金属腐蚀的实验,下列相关说法正确的是


| A.食盐水中有气泡逸出 |
B.铁表面的反应为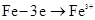 |
| C.红色首先在食盐水滴的中心出现 |
| D.该实验研究的是金属的吸氧腐蚀 |
D
生铁中的铁与碳组成原电池的负极与正极,而中性的食盐水为电解质溶液,可见本实验研究的是金属的吸氧腐蚀。
负极:Fe-2e-=Fe2+ 正极:O2+2H2O+4e-=4OH-
由电极反应可知,食盐水中无气泡放出,由于氧气在食盐水滴边上的浓度相对大,所以水滴边上更容易生成OH-使溶液呈碱性,导致红色的出现。
故答案为D
负极:Fe-2e-=Fe2+ 正极:O2+2H2O+4e-=4OH-
由电极反应可知,食盐水中无气泡放出,由于氧气在食盐水滴边上的浓度相对大,所以水滴边上更容易生成OH-使溶液呈碱性,导致红色的出现。
故答案为D

练习册系列答案
相关题目


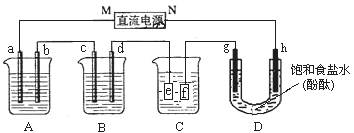
 2 PbSO4 (s) +2 H2O (l) 电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
2 PbSO4 (s) +2 H2O (l) 电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )

 、h都是惰性电极。A中盛有100mlCuSO4溶液;B中盛有100g质量分数为16%的氢氧化钠溶液;将电源接通后,在g极附近显红色。
、h都是惰性电极。A中盛有100mlCuSO4溶液;B中盛有100g质量分数为16%的氢氧化钠溶液;将电源接通后,在g极附近显红色。