��Ŀ����
����Ŀ����.��ҵ�Ͽ���CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�������ʾ��
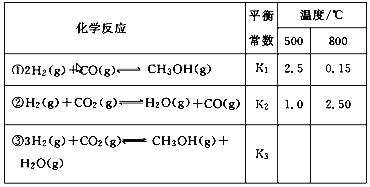
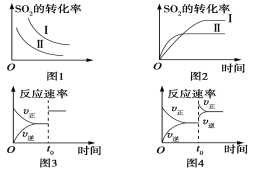
��1���ݷ�Ӧ���������Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3��_______����K1��K2��ʾ����
��2��500 ��ʱ��÷�Ӧ����ijʱ�̣�H2��g����CO2��g����CH3OH��g����H2O��g����Ũ�ȣ�mol��L��1���ֱ�Ϊ0.8��0.1��0.3��0.15�����ʱv��________v��������>��������������<������
��.����CO��H2���Ժϳɼ״�����Ӧԭ��ΪCO��g����2H2��g��![]() CH3OH��g����һ�������£����ݻ�ΪV L���ܱ������г���a mol CO��2a mol H2�ϳɼ״���ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
CH3OH��g����һ�������£����ݻ�ΪV L���ܱ������г���a mol CO��2a mol H2�ϳɼ״���ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��

��1��p1___p2������>������<��������������������_______________��
��2���ü״��ϳɷ�Ӧ��A���ƽ�ⳣ��K��_________����a��V��ʾ����
��3���÷�Ӧ�ﵽƽ��ʱ����Ӧ��ת���ʵĹ�ϵ��CO_____H2������>������<��������������
��4�����д�ʩ���ܹ�ͬʱ��������Ӧ���ʺ����COת���ʵ���________������ĸ����
A��ʹ�ø�Ч���� B�����ͷ�Ӧ�¶�
C��������ϵѹǿ D�����Ͻ�CH3OH�ӷ�Ӧ������з������
���𰸡�K1K2 > < ��ͬ�¶��£�P1ѹǿ��CO��ת���ʱ�P2ѹǿ��CO��ת���ʵ� ![]() �� C
�� C
��������
��.��1�����ݸ�˹���ɣ�������ʽ��+�ٵ÷���ʽ�ۣ���ƽ�ⳣ��K3= K1K2��
��2������¶ȱ仯���������¶����ߣ�ƽ�ⳣ����С��ƽ��������У������жϷ�Ӧ�Ƿ��ȷ�Ӧ���ʱ���H<0����500�桢2L���ܱ������У����з�Ӧ�ۣ���÷�Ӧ����ijʱ�̣�H2��g����CO2��g����CH3OH��g����H2O ��g����Ũ�ȣ�mol/L���ֱ�Ϊ0.8��0.1��0.3��0.15��Q=![]() =0.87<K=2.5����Ӧ������У�v��>v����
=0.87<K=2.5����Ӧ������У�v��>v����
��. (1)�״��ĺϳɷ�Ӧ�Ƿ��������ٵķ�Ӧ����ͬ�¶���,����ѹǿ,ƽ��������Ӧ�����ƶ�����CO��ת����������ͼ��֪��P1<p2���ʴ�Ϊ: < ���״��ĺϳɷ�Ӧ�Ƿ��������ٵķ�Ӧ,��ͬ�¶���,����ѹǿCO��ת������ߣ�
(2)����ͼ��֪����A��, CO��ת����Ϊ0.75 ,����ƽ��ʱn(CO)=amol��(1-0.75) =0.25amol , n(CH3OH) =c(CO) (�μӷ�Ӧ) =amol��0.5=0.75amol, n(H2) =2amol-2��amol��0.75=0.5amol ,��c(CO)=![]() mol/L��c(CH3OH) =
mol/L��c(CH3OH) = ![]() mol/L��c(H2)=
mol/L��c(H2)=![]() mol/L ,����K=
mol/L ,����K= =
=![]() ��
��
(3)��Ӧ�������֮�ȵ��ڷ�Ӧ����ʽ�е�ϵ��֮�ȣ������ַ�Ӧ��ת������ȣ��÷�Ӧ�з�Ӧ��CO��H2��ϵ��֮��Ϊ1 : 2 ������Ͷ�������֮�ȣ�����CO��H2��ת������ȣ�
(4)A��ʹ�ø�Ч��������Ӧ���ʼӿ�,��ƽ�ⲻ�ƶ���ѡ��A��ѡ��
B�����ͷ�Ӧ�¶ȣ���Ӧ���ʼ�����ѡ��B��ѡ��
C��������ϵѹǿ����Ӧ���ʼӿ죬ƽ�������ƶ��� CO��ת��������ѡ��Cѡ��
D�����Ͻ�CH3OH�ӷ�Ӧ������з����������Ӧ���ʼ�����ѡ��D��ѡ��
��ѡC��

����Ŀ�����ᣨH2C2O4����һ�ֶ�Ԫ���ᣬ�㷺�ֲ��ڶ�ֲ�����С�
��1�������ڲ����ۻ������ǵ��½�ʯ����Ҫ�ɷ��Dz���ƣ��γɵ�ԭ��֮һ�����о����֣�EDTA��һ���ܽ�Ͻ������ӵ��Լ�����һ�������¿�����Ч�ܽ��ʯ���û�ѧƽ��ԭ��������ԭ��_______________��
��2����֪��0.1 mol��L��1KHC2O4��Һ�����ԡ�����˵����ȷ����_______������ĸ��ţ���
a. 0.1 mol��L��1KHC2O4��Һ�У�c(K+) + c(H+) = c(HC2O4-) + 2c(C2O42-) + c(OH-)
b. 0.1 mol��L��1KHC2O4��Һ�У�c(K+) > c(HC2O4-) > c(C2O42-) > c(H2C2O4)
c. Ũ�Ⱦ�Ϊ0.1 mol��L��1KHC2O4��K2C2O4�Ļ����Һ�У�2c(K+) = c(HC2O4-) + c(C2O42-)
d. 0.1 mol/L KHC2O4��Һ�еμӵ�Ũ��NaOH��Һ�����ԣ�c(K+) > c(Na+)
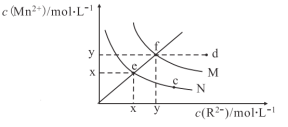
��3�����ò����Ʊ�������������(FeC2O4��xH2O)�����̼���ֲⶨ�������£�
![]()
��֪��i. pH>4ʱ��Fe2+�ױ���������
ii. �������ʵ��ܽ��(g /100g H2O)����
FeSO4��7H2O | (NH4)2SO4 | FeSO4��(NH4)2SO4��6H2O | |
20�� | 48 | 75 | 37 |
60�� | 101 | 88 | 38 |
����ϡ�������ҺpH��1��2��Ŀ���ǣ�_____________��______________��
�����ȹ��˵�ԭ���ǣ�_______________��
��������ԭ�ζ��������ڲⶨ�������������Ħ������(M)����ȡa g����������������ϡ�����У���b mol��L��1�ĸ�����ر�Һ�ζ�������ζ��յ�ʱ�����ĸ������VmL����M =__________��(��֪�����ַ�Ӧ����ΪMn2+��Fe3+��CO2)