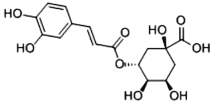
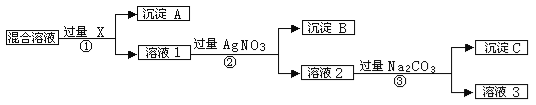
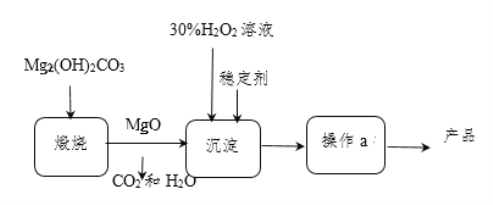
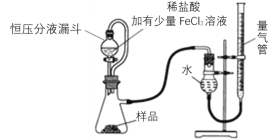
题目内容
【题目】若将0.2 mol钠、镁、铝分别投入到10 mL 1 mol·L-1盐酸中,在标准状况下产生氢气的体积由大到小的顺序是
A.V(Na)=V(Al)=V(Mg)B.V(Al)>V(Mg)>V(Na)
C.V(Al)=V(Mg)>V(Na)D.V(Na)>V(Al)=V(Mg)
【答案】D
【解析】
0.2mol钠在反应中一共可以失去0.2mol电子,这些电子全部被![]() 得到可以产生0.1mol氢气,0.2mol镁一共可以失去0.4mol电子,但是千万不能误认为此处可以产生0.2mol氢气,因为镁只与盐酸反应,盐酸中一共只有0.01mol
得到可以产生0.1mol氢气,0.2mol镁一共可以失去0.4mol电子,但是千万不能误认为此处可以产生0.2mol氢气,因为镁只与盐酸反应,盐酸中一共只有0.01mol![]() ,所以只能产生0.005mol氢气,镁过量;对铝进行同样的计算可以发现铝也是过量的,只能产生0.005mol氢气。因此三者产生氢气的体积由大到小的顺序是V(钠)>V(铝)=V(镁),答案选D。
,所以只能产生0.005mol氢气,镁过量;对铝进行同样的计算可以发现铝也是过量的,只能产生0.005mol氢气。因此三者产生氢气的体积由大到小的顺序是V(钠)>V(铝)=V(镁),答案选D。

【题目】从能量的变化和反应的快慢等角度研究反应具有重要意义。
(1)已知反应2H2(g)+O2(g)=2H2O(g)为放热反应,下图能正确表示该反应中能量变化的是_______ 。
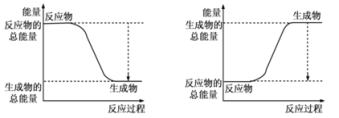
A B
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如上表:则生成1mol液态水可以放出热量____________kJ
(2)将质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是______________, 正极的反应式为______________,电解质溶液中SO42- 移向______极(填“正”或“负”)。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为______ ;X为______ 。若反应经2min时C的浓度______ 0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为______ ;X为______ 。若反应经2min时C的浓度______ 0.8mol/L(填“大于,小于或等于”)。