题目内容
【题目】碳热还原法广泛用于合金及材料的制备。回答下列问题
(1) 一种制备氮氧化铝的反应原理为23Al2O3+ 15C+5N2=2Al23O27N5+15CO,产物Al23O27N5 中氮的化合价为_____,该反应中每生成 l mol Al23O27N5转移的电子数为_______________ 。
(2) 真空碳热冶铝法包含很多反应.其中的三个反应如下:
Al2O3 (s) +3C(s)=Al2OC(s) +2CO(g) △H1
2Al2OC(s)+3C(s)=Al4C3(s)+2CO(g) △H2
2Al2O3(s) +9C(s)= Al4C3(s)+6CO(g) △H3
①△H3=________ ( 用△H1、△H2表示).
②Al4C3可与足量盐酸反应制备简单的烃。该反应的化学方程式为____________。
(3)下列是碳热还原制锰合金的三个反应 ,CO与CO2平衡分压比的自然对数(![]() ) 与温度的关系如图所示(已知Kp 是用平衡分压代替浓度计算所得的平衡常数,分压=总压 × 气体的物质的量分数)。
) 与温度的关系如图所示(已知Kp 是用平衡分压代替浓度计算所得的平衡常数,分压=总压 × 气体的物质的量分数)。
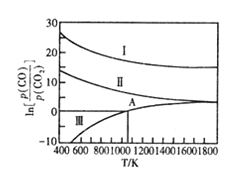
I. Mn3C(s)+4CO2(g) 3MnO(s)+ 5CO(g) Kp(I)
II. Mn(s) +CO2(g) MnO(s) +CO(g) Kp (II)
III. Mn3C(s)+CO2(g) 3Mn(s) +2CO(g) Kp(III)
①△H>O的 反应是_________ (填“I ”“II” 或“III”)。
②1200K时在 一体积为 2L 的恒容密闭容器中有17.7gMn3C( s)和0.4molCO2 ,只发生反应I,5min后达到平衡,此时CO的浓度为0.125mol/L,则0~5 min内 v(CO2)=_______。
③在一体积可变的密闭容器中加入一定量的Mn(s )并充入一定量的CO2(g) .只发生反应
II,下列能说明反应II 达到平衡状态的是________ (填标号)。
A. 容器的体积不再改变
B.固体的质量不再改变
C.气体的总质量不再改变
④向恒容密闭容器中加入Mn3C并充入0.l molCO2, 若只发生反应III. 则在A点反应达到平衡时,容器的总压为akPa, CO2的转化率为______; A点对应温度下的Kp(III) =______。
【答案】-3 9.03×1024(或15NA) 2△H1 +△H2 Al4C3+12HCl=4AlCl3+3CH4↑ III 0.02molL-1min-1 BC 33.3% 0.5akPa
【解析】
(1)反应23Al2O3+15C+5N2=2Al23O27N5+15CO中,产物Al23O27N5中氮的化合价为-3价,该反应中每生成1mol Al23O27N5,转移的电子数为5×3NA =15 NA,故答案为:-3;9.03×1024(或15NA);
(2)已知Ⅰ、Al2O3(s)+3C(s)=Al2OC(s)+2CO(g) ΔH1
Ⅱ、2Al2OC(s)+3C(s)=Al4C3(s)+2CO(g) ΔH2
Ⅲ2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) ΔH3
①根据盖斯定律,由Ⅰ×2+Ⅱ得反应Ⅲ2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) ΔH3= 2ΔH1+ΔH2,故答案为:2△H1 +△H2;
②Al4C3可与足量盐酸反应制备一种最简单的烃CH4,根据质量守恒配平可得反应的化学方程式为Al4C3+12HC1=4AlCl3+3CH4↑,故答案为:Al4C3+12HC1=4AlCl3+3CH4↑;
(3)①由图中信息可知,反应Ⅲ升高温度,lnK增大,则K增大,平衡正向移动,正反应为吸热反应,ΔH>0,故答案为:Ⅲ;
②0~5min内v(CO2)=![]() v(CO)=
v(CO)=![]() ×
×![]() mol·L-1·min-1,故答案为:0.02molL-1min-1;
mol·L-1·min-1,故答案为:0.02molL-1min-1;
③反应Ⅱ.Mn(s)+CO2(g)![]() MnO(s)+CO(g)为气体体积不变的放热反应,根据“变量不变达平衡”进行判断;
MnO(s)+CO(g)为气体体积不变的放热反应,根据“变量不变达平衡”进行判断;
A.反应为气体不变的反应,反应过程容器的体积不是变量,不能作为平衡状态的判断依据,选项A不选;
B.反应是一个固体质量增大的反应,固体的质量为变量,当固体的质量不再改变说明达到平衡状态,选项B选;
C.反应是一个气体质量减小的反应,气体的总质量为变量,当不再改变说明达平衡状态,选项C选。
故答案为:BC;
④向恒容密闭容器中加入Mn3C并充入0.1molCO,若只发生反应Ⅲ,则在A点反应达到平衡,ln![]() ,则
,则![]() ,当容器的总压为akPa时,CO的转化率为
,当容器的总压为akPa时,CO的转化率为![]() ,A点对应温度下的Kp(Ⅲ)=
,A点对应温度下的Kp(Ⅲ)=![]() 0.5akPa,故答案为:33.3%;0.5akPa。
0.5akPa,故答案为:33.3%;0.5akPa。