题目内容
8.下列关于卤素的叙述正确的是( )| A. | 随核电荷数增加卤素原子半径增大 | B. | 随核电荷数增加,单质熔沸点升高 | ||
| C. | 随核电荷数增加,单质氧化性增强 | D. | 随核电荷数增加氢化物越来越稳定 |
分析 卤族元素由上到下,非金属性减弱,以此比较单质的氧化性、气态氢化物的稳定性、阴离子的还原性;卤族元素由上到下,颜色加深、单质的沸点升高,而气态氢化物中HF中含氢键,沸点较高,以此来解答.
解答 解:A.同主族元素从上到下,电子层数逐渐增多,原子半径逐渐增大,故A正确;
B.卤族元素从上到下对应单质的相对分子质量逐渐增大,因都为分子晶体,则晶体熔沸点逐渐升高,故B正确;
C.同主族元素从上到下元素的非金属性逐渐减弱,对应单质的氧化性逐渐减弱,故C错误;
D.同主族元素从上到下元素的非金属性逐渐减弱,对应的氢化物的稳定性逐渐减弱,故D错误.
故选AB.
点评 本题考查卤素原子结构与性质的比较,侧重元素周期表、元素周期律及非金属性比较的考查,注重规律性知识的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.Wg镁粉和铝粉的混合物,和过量盐酸反应使金属完全溶解、在加过量的 NaOH反应,然后过滤,将沉淀完全收集后,放坩埚中灼烧,直至物质质量不再变化,取出物质称量仍为wg.求原混合物中铝粉的质量分数约为( )
| A. | 40.0% | B. | 58.6% | C. | 60.0% | D. | 47.1% |
14.下列叙述正确的是( )
| A. | 煤的干馏和石油的分馏均属化学变化时,煤的气化和液化属于物理变化 | |
| B. | 溶液和胶体的本质区别是丁达尔效应 | |
| C. | 有单质参加和生成的化学反应一定是氧化还原反应 | |
| D. | 将浓度为18.4mol/L质量分数为98%的浓硫酸加水稀释至9.2 mol/L,则稀释后溶质的质量分数大于49% |
11.下列叙述正确的是( )
| A. | 将5.85 g NaCl晶体溶入100 mL水中,制得0.1 mol/L NaCl溶液 | |
| B. | 将1体积c mol/L硫酸溶液用水稀释为5体积,得到0.2c mol/L硫酸溶液 | |
| C. | 将25 g无水CuSO4溶于水制成100 mL溶液,其浓度为1 mol/L | |
| D. | 将w g a% NaCl溶液蒸发掉w/2 g水,得到4a% NaCl溶液 |
3.为了预防碘缺乏症,国家规定每千克食盐中应含40~50mg碘酸钾.碘酸钾晶体有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂作用生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等强氧化剂氧化为更高价的碘的含氧酸盐.
问题1 工业生产碘酸钾的流程如下:

(1)碘、氯酸钾和水混合后的反应为(未配平):I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑.该方程式配平时,系数有多组,原因是有两种还原产物生成.
(2)X的化学式为KOH;写出用试剂X调节pH的化学方程式:KH(IO3)2+KOH→2KIO3+H2O.
(3)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应后溶液的pH,对生产碘酸钾有什么具体影响?反应产生的氯气跟KOH反应生成KClO,KClO能将KIO3氧化成KIO4从而不能得到碘酸钾.
问题2 已知:KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O; I2+2S2O32-→2I-+S4O62-.
(4)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应.用四氯化碳检验碘单质时,看到的明显现象有液体分层,下层液体呈现紫红色.
(5)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL恰好反应.则加碘食盐样品中的碘元素含量是$\frac{1270}{3w}$mg/kg(以含w的代数式表示).
(6)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
①推测实验中产生蓝色现象的可能原因,用离子方程式表示4I-+4H++O2→2I2+2H2O.
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价:因加入了过量KI溶液,乙实验结果会偏大.
问题1 工业生产碘酸钾的流程如下:

(1)碘、氯酸钾和水混合后的反应为(未配平):I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑.该方程式配平时,系数有多组,原因是有两种还原产物生成.
(2)X的化学式为KOH;写出用试剂X调节pH的化学方程式:KH(IO3)2+KOH→2KIO3+H2O.
(3)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应后溶液的pH,对生产碘酸钾有什么具体影响?反应产生的氯气跟KOH反应生成KClO,KClO能将KIO3氧化成KIO4从而不能得到碘酸钾.
问题2 已知:KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O; I2+2S2O32-→2I-+S4O62-.
(4)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应.用四氯化碳检验碘单质时,看到的明显现象有液体分层,下层液体呈现紫红色.
(5)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL恰好反应.则加碘食盐样品中的碘元素含量是$\frac{1270}{3w}$mg/kg(以含w的代数式表示).
(6)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol•L-1 KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol•L-1的H2SO4,振荡. | 溶液变蓝色 |
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价:因加入了过量KI溶液,乙实验结果会偏大.
13.利用自然资源制备相关化学物质,下列化学工艺不可行的是( )
| A. | 提取食盐后的母液$\stackrel{Cl_{2}}{→}$含Br2的液体$\stackrel{热空气}{→}$$\stackrel{冷凝}{→}$粗溴$→_{蒸馏}^{NaBr(s)}$纯溴 | |
| B. | 石英砂$→_{高温}^{焦炭}$粗硅$→_{高温}^{Cl_{2}}$粗四氯化硅$\stackrel{分馏}{→}$$→_{高温}^{H_{2}}$高纯硅 | |
| C. | FeS2$→_{高温}^{O_{2}}$SO2$\stackrel{水}{→}$H2SO3$\stackrel{O_{2}}{→}$H2SO4 | |
| D. | 铝土矿$→_{过滤}^{NaOH溶液}$Na[Al(OH)4]溶液$→_{过滤}^{CO_{2}}$Al(OH)3$\stackrel{煅烧}{→}$Al2O3$→_{电解}^{冰晶石}$铝 |
20.某盐的混合物中含有0.2mol Na+、0.4mol Mg2+、0.4mol Cl -,则SO42-为( )
| A. | 0.1 mol | B. | 0.3 mol | C. | 0.5 mol | D. | 0.15 mol |
17.2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究.下列关于
${\;}_{78}^{202}$Pt的说法正确的是( )
${\;}_{78}^{202}$Pt的说法正确的是( )
| A. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的质子数相同,互称为同位素 | |
| B. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的中子数相同,互称为同位素 | |
| C. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt是同一种核素 | |
| D. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的质量数不同,不能互称为同位素 |
18.某研究性学习小组设计除去锅炉水垢(CaCO3、Mg(OH)2、CaSO4)的实验,查找各物质的溶解度数据如下.
设计流程如下(所加的试剂均过量):
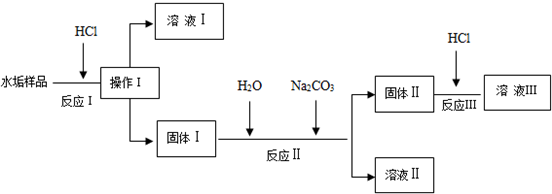
(1)操作Ⅰ的名称是过滤.
(2)溶液Ⅰ和溶液Ⅲ都含有的溶质是HCl、CaCl2.
(3)写出发生在上述过程中符合“盐+酸=另一种盐+另一种酸”特征的反应方程式CaCO3+2HCl=CaCl2+CO2↑+H2O.
写出反应Ⅱ的离子方程式CaSO4+CO32-=CaCO3+SO42-.
(4)上述过程中哪一步反应是利用了上述溶解度表设计的B.
A.反应ⅠB.反应ⅡC.反应Ⅲ
(5)溶液Ⅱ中的含氧酸根的检验方法是:取少量溶液II,先加盐酸无现象,再加氯化钡生成白色沉淀,则证明含硫酸根离子.
| 化学式 | CaSO4 | CaCO3 | Ca(OH)2 | CaCl2 |
| 溶解度/g | 0.21 微溶 | <0.01 | 0.077 | 74.5 |

(1)操作Ⅰ的名称是过滤.
(2)溶液Ⅰ和溶液Ⅲ都含有的溶质是HCl、CaCl2.
(3)写出发生在上述过程中符合“盐+酸=另一种盐+另一种酸”特征的反应方程式CaCO3+2HCl=CaCl2+CO2↑+H2O.
写出反应Ⅱ的离子方程式CaSO4+CO32-=CaCO3+SO42-.
(4)上述过程中哪一步反应是利用了上述溶解度表设计的B.
A.反应ⅠB.反应ⅡC.反应Ⅲ
(5)溶液Ⅱ中的含氧酸根的检验方法是:取少量溶液II,先加盐酸无现象,再加氯化钡生成白色沉淀,则证明含硫酸根离子.