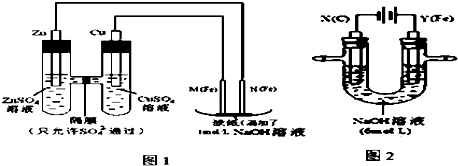
题目内容
13.利用自然资源制备相关化学物质,下列化学工艺不可行的是( )| A. | 提取食盐后的母液$\stackrel{Cl_{2}}{→}$含Br2的液体$\stackrel{热空气}{→}$$\stackrel{冷凝}{→}$粗溴$→_{蒸馏}^{NaBr(s)}$纯溴 | |
| B. | 石英砂$→_{高温}^{焦炭}$粗硅$→_{高温}^{Cl_{2}}$粗四氯化硅$\stackrel{分馏}{→}$$→_{高温}^{H_{2}}$高纯硅 | |
| C. | FeS2$→_{高温}^{O_{2}}$SO2$\stackrel{水}{→}$H2SO3$\stackrel{O_{2}}{→}$H2SO4 | |
| D. | 铝土矿$→_{过滤}^{NaOH溶液}$Na[Al(OH)4]溶液$→_{过滤}^{CO_{2}}$Al(OH)3$\stackrel{煅烧}{→}$Al2O3$→_{电解}^{冰晶石}$铝 |
分析 A、提取食盐后的母液中提取单质溴的过程;
B、是工业上制高纯硅的流程;
C、应首先进行二氧化硫的催化氧化,然后用98.3%的硫酸吸收;
D、工业上用铝土矿制铝的过程.
解答 解:A、提取食盐后的母液中提取单质溴的过程,要知道母液中是溴离子,工艺可行的,故A不选;
B、是工业上制高纯硅的流程,工艺可行的,故B不选;
C、应首先进行二氧化硫的催化氧化,然后用98.3%的硫酸吸收,工艺不可行,故C选;
D、工业上用铝土矿制铝的过程,每一步所加试剂必须过量,工艺可行的,故D不选;
故选C.
点评 本题考查的是利用自然资源制备相关化学物质,学生要结合所学知识和反应的原理综合分析,比较简单.

练习册系列答案
相关题目
18.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)═PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:
下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20 mol PCl3 和0.20molCl2,反应达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3 和2.0molCl2,达到平衡时,PCl3的转化率小于80% |
19.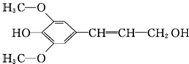 膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )
 膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )| A. | 芥子醇的分子式是C11H12O4 | |
| B. | 芥子醇分子中所有碳原子不可能在同一平面 | |
| C. | 芥子醇能与FeCl3溶液发生显色反应 | |
| D. | 1mol芥子醇能与足量溴水反应消耗3mol Br2 |
1.某学习小组模拟工业上由铝矾土(含Al203和少量的Si02及铁的氧化物)制备 金属铝的方法,设计了实验室用铝矾土制备金属铝的方案,主要流程如图所示:
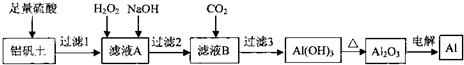
已知:
(1)为了加快铝矾土的酸溶速率,除了反应过程不断搅拌外,还可釆取的措施有升高反应温度,增大硫酸浓度,粉碎铝土矿等(至少二条).
(2)加入H202时,发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.要检验Fe2+是否反应完全应选择的试剂是KMnO4.(供选试剂:KMn04溶液、KSCN溶液、NaOH溶液、H202溶液).加入NaOH调节滤液A的pH在10.8--14范围.
(3)流程中有多次过滤,需制作一个简单的过滤器,所需的用品有漏斗,滤纸
(4)电解Al2O3时阳极生成的02全部与石墨反应转化为C02和CO.相关反应的热化学 方程式如下:
C(s,石墨)+02(g)=C02(g)△H=-393.5kJ•mol-1
2C(s,石墨)+02(g)=2C0(g)△T=-221.0kJ•mol-1
若C02和CO的体积比为1:1,当阴极得到27g铝时,若阳极生成的气体用作燃料能放出热量141.5 kJ.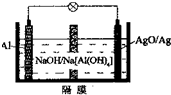
(5)新型铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池正极反应式为AgO+H2O+2e-=Ag+2OH-.

已知:
| 氢氧化物 | 开始沉淀pH | 沉淀完全pH | 开始溶解pH | 溶解完全pH |
| Fe(OH)3 | 2.3 | 4.1 | 14 | - |
| Al(OH)3 | 2.3 | 5.2 | 7.8 | 10.8 |
(2)加入H202时,发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.要检验Fe2+是否反应完全应选择的试剂是KMnO4.(供选试剂:KMn04溶液、KSCN溶液、NaOH溶液、H202溶液).加入NaOH调节滤液A的pH在10.8--14范围.
(3)流程中有多次过滤,需制作一个简单的过滤器,所需的用品有漏斗,滤纸
(4)电解Al2O3时阳极生成的02全部与石墨反应转化为C02和CO.相关反应的热化学 方程式如下:
C(s,石墨)+02(g)=C02(g)△H=-393.5kJ•mol-1
2C(s,石墨)+02(g)=2C0(g)△T=-221.0kJ•mol-1
若C02和CO的体积比为1:1,当阴极得到27g铝时,若阳极生成的气体用作燃料能放出热量141.5 kJ.

(5)新型铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池正极反应式为AgO+H2O+2e-=Ag+2OH-.
8.下列关于卤素的叙述正确的是( )
| A. | 随核电荷数增加卤素原子半径增大 | B. | 随核电荷数增加,单质熔沸点升高 | ||
| C. | 随核电荷数增加,单质氧化性增强 | D. | 随核电荷数增加氢化物越来越稳定 |
18.居室装修用石材的放射性常用22688Ra作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖.下列叙述中正确的是( )
| A. | RaCl2的分子量更大,熔沸点比CaCl2高 | |
| B. | Ra元素位于元素周期表中第六周期ⅡA族 | |
| C. | Ra(OH)2是一种两性氢氧化物 | |
| D. | 一个22688Ra原子中含有138个中子 |
5.下列有关试纸的使用及实验现象的叙述正确的是( )
| A. | 用湿润的pH试纸测定溶液的pH,所测pH一定不准 | |
| B. | 使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 | |
| C. | 使湿润的红色石蕊试纸褪色的气体必然是SO2 | |
| D. | 用湿润的红色石蕊试纸检验NH3 |
3.除杂提纯下列各物质,请写出所选化学试剂的化学式及反应的离子方程式.
| 混合物成分 | 化学试剂 | 离子方程式 |
| Na2SO4中含有少量Na2CO3杂质 | ||
| FeCl2中含有少量FeCl3杂质 | ||
| NaNO3中含有少量NaCl杂质 |