题目内容
【题目】已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K、L、M三个电子层.回答下列问题:
(1)A、B、C、D、E、F、G几种元素中第一电离能最小的是(填元素符号),D元素的原子核外有种不同运动状态的电子,有种不同能级的电子,基态的F3+核外电子排布式是 .
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是 .
(3)化合物AC2的电子式是 .
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 .
(5)化合物EF[F(AB)6]是一种蓝色晶体,如图1表示其晶胞的 ![]() (E+未画出).该蓝色晶体的一个晶胞中E+的个数为 .
(E+未画出).该蓝色晶体的一个晶胞中E+的个数为 . 
(6)G的二价阳离子能与乙二胺(H2N﹣CH2一CH2一NH2)形成配离子(如图2):该配离子中含有的化学键类型有 . (填字母) 
a.配位键 b.极性键 c.离子键 d.非极性键
阴离子CAB﹣中的A原子与乙二胺(H2N﹣CH2一CH2一NH2)中C原子的杂化方式分别为和
【答案】
(1)K;17;5;1s22s22p63s23p63d5
(2)NH3与H2O分子间存在氢键,CH4、H2S分子与H2O分子间不存在氢键
(3)![]()
(4)K2Fe(SCN)5
(5)4
(6)abd;sp;sp3
【解析】解:A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,A、B、C、D、E为不同主族的元素,A、C的最外层电子数都是其电子层数的2倍,A为C、C为S元素;透过蓝色钴玻璃观察E的焰色反应为紫色,则E为K元素,D原子序数大于C而小于E为主族元素,则D是Cl元素;
B的电负性大于C,且原子序数小于C,且主族元素处于不同主族,则B为N元素;
F的基态原子中有4个未成对电子,且位于第四周期元素,则F为Fe元素;G的+1价阳离子正好充满K、L、M三个电子层,则G为Cu元素;(1)元素的金属性越强,其第一电离能越小,这几种元素中金属性最强的是K,则第一电离能最小的是K;
D是Cl元素,原子核外有多少个电子,电子就有多少种运动状态,所以Cl元素原子核外电子有17种运动状态,有5种不同的能级;F是Fe元素,失去三个电子生成铁离子,铁离子核外有23个电子,根据构造原理知铁离子核外电子排布式为1s22s22p63s23p63d5 ,
所以答案是:K;17;5;1s22s22p63s23p63d5;(2)B的氢化物是氨气、C的氢化物是硫化氢、A的氢化物是甲烷,硫化氢、甲烷和水分子不能形成氢键、氨气和水分子能形成氢键,氢键的存在促进其溶解度增大,所以氨气的溶解度大于甲烷和硫化氢,
所以答案是:NH3与H2O分子间存在氢键,CH4、H2S分子与H2O分子间不存在氢键;(3)化合物CS2的电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(4)FeCl3与KSCN溶液混合得到含多种配合物的血红色溶液,生成的配合物为铁氰化钾,其中配位数为5的配合物的化学式是K2Fe(SCN)5 , 所以答案是:K2Fe(SCN)5;(5)化合物KFe[Fe(CN)6]是一种蓝色晶体,如图1表示其晶胞的
;(4)FeCl3与KSCN溶液混合得到含多种配合物的血红色溶液,生成的配合物为铁氰化钾,其中配位数为5的配合物的化学式是K2Fe(SCN)5 , 所以答案是:K2Fe(SCN)5;(5)化合物KFe[Fe(CN)6]是一种蓝色晶体,如图1表示其晶胞的 ![]() (E+未画出),该晶胞中Fe2+个数=
(E+未画出),该晶胞中Fe2+个数= ![]() =4,Fe3+个数=
=4,Fe3+个数= ![]() =4,CN﹣个数=12×
=4,CN﹣个数=12× ![]() ×8=24,根据化合物中各元素化合价的代数和为0知,K+个数=
×8=24,根据化合物中各元素化合价的代数和为0知,K+个数= ![]() =4,所以答案是:4;(6)Cu的二价阳离子能与乙二胺(H2N﹣CH2一CH2一NH2)形成配离子(如图2),C﹣C原子之间存在非极性键、C﹣N和C﹣H及N﹣H原子之间存在极性键,铜离子和氮原子之间存在配位键,所以该配离子中含有的化学键类型有配位键、极性键、非极性键,故选abd;
=4,所以答案是:4;(6)Cu的二价阳离子能与乙二胺(H2N﹣CH2一CH2一NH2)形成配离子(如图2),C﹣C原子之间存在非极性键、C﹣N和C﹣H及N﹣H原子之间存在极性键,铜离子和氮原子之间存在配位键,所以该配离子中含有的化学键类型有配位键、极性键、非极性键,故选abd;
SCN﹣中的C原价层电子对个数是2且不含孤电子对,所以C原子杂化方式为sp,乙二胺(H2N﹣CH2一CH2一NH2)中C原子价层电子对个数是4且不含孤电子对,所以C的杂化方式为sp3 ,
所以答案是:abd;sp;sp3 .

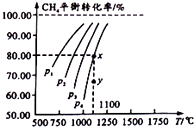
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH,CO,H2的浓度都不再发生变化
E.容器中气体的压强不再改变
(2)表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①写出该反应的平衡常数K的表达式
②由表中数据判断该反应的△H0(填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,5min时达到平衡,测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 , 在0~5min内,以H2表示的平均反应速率为molL﹣1min﹣1 , 平衡时CH3OH的浓度为molL﹣1