��Ŀ����
����Ŀ���ݱ�����һ���������ɶ�����̼�������ϳ��Ҵ��ѳ�Ϊ��ʵ��
��֪����CH3CH2OH��l��+3O2��g���T2CO2��g��+3H2O��l����H=��1366.8kJ/mol
��2H2��g��+O2��g���T2H2O��l����H=��571.6kJ/mol
��1��д����CO2��H2��Ӧ�ϳ�CH3CH2OH��l����H2O��l�����Ȼ�ѧ����ʽ
��2�������Ҵ�ȼ�ϵ���״��棬���ƹ㣬�Ի�����ȾС�����зdz������ķ�չǰ������ȼ�ϵ���У�ʹ�ò����缫��KOH��Һ���������Һ��ͨ���Ҵ�ȼ����һ��Ϊ�����ü��ϵĵ缫��ӦʽΪ ��
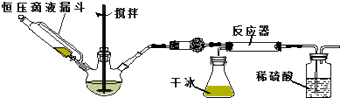
��3�����Ҵ�ȼ�ϵ�ص��400mL ����ʳ��ˮװ�ÿɼ�ʾ��ͼ����װ���з�����ⷴӦ�ķ���ʽΪ�������������۲쵽��������������������448mL���壨����ڱ�״���²�ã�ʱ��ֹͣ��⣬���������Һ��Ͼ��ȣ���Һ��pHΪ �� ��������������ܽ⼰��Һ����ı仯�� 
���𰸡�
��1��2CO2��g��+6H2��g��=CH3CH2OH��l��+3H2O��l����H=��348kJ/mol
��2������C2H6O+16OH����12e��=2CO32��+11H2O
��3��2NaCl+2H2O ![]() Cl2��+H2��+2NaOH����Һ��죻13
Cl2��+H2��+2NaOH����Һ��죻13
���������⣺��1����CH3CH2OH��l��+3O2��g��=2CO2��g��+3H2O��l����H=��1366.8kJ/mol����2H2��g��+O2��g��=2H2O��l����H=��571.6kJ/mol��
���ݸ�˹���ɣ��ڡ�3���ٿɵã�2CO2��g��+6H2��g��=CH3CH2OH��l��+3H2O��l����H=����571.6kJ/mol����3������1366.8kJ/mol��=��348kJ/mol��
���Դ��ǣ�2CO2��g��+6H2��g��=CH3CH2OH��l��+3H2O��l����H=��348kJ/mol����2�����Ҵ�ȼ�ϵ���У���������ȼ���Ҵ�����ʧ���ӵ�������Ӧ���ڼ��Ի����µĵ缫��ӦΪ��C2H6O+16OH����12e��=2CO32��+11H2O��
���Դ��ǣ�����C2H6O+16OH����12e��=2CO32��+11H2O����3������ͼʾ��֪�����ĵ缫���ӵ�Դ�ĸ�����Ϊ���ص�����������������ԭ��Ӧ�����������Ҳ�����ԭ��ص�ֱ�ӣ����Ե��ص��Ҳ�Ϊ��������������������Ӧ�����������缫����ʳ��ˮ�ķ���ʽΪ��2NaCl+2H2O ![]() Cl2��+H2��+2NaOH��
Cl2��+H2��+2NaOH��
������ˮ����������ӷŵ磬ʹˮ�ĵ���ƽ�������ƶ�������������Ũ���������Դ��з�̪����Һ��죻
�������ɱ���µ�448mL���壬������Ϊ�����������448mL���������ʵ���Ϊ0.02mol�����ݷ�Ӧ����ʽ2NaCl+2H2O ![]() Cl2��+H2��+2NaOH��֪������0.02mol����������0.04mol�������ƣ������Һ������������Ũ��Ϊ��c��OH����=c��NaOH��=
Cl2��+H2��+2NaOH��֪������0.02mol����������0.04mol�������ƣ������Һ������������Ũ��Ϊ��c��OH����=c��NaOH��= ![]() =0.1mol/L����Һ��������Ũ��Ϊ��1��10��13mol/L����Һ��pH=13��
=0.1mol/L����Һ��������Ũ��Ϊ��1��10��13mol/L����Һ��pH=13��
���Դ��ǣ�2NaCl+2H2O ![]() Cl2��+H2��+2NaOH����Һ��죻13��
Cl2��+H2��+2NaOH����Һ��죻13��