题目内容
【题目】将浓度为0.1 mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是( )
A. c(H+) B. Ka(HF) C.  D.
D. 
【答案】D
【解析】试题分析:A、因HF为弱酸,则浓度为0.1molL-1HF溶液加水不断稀释,促进电离,平衡正向移动,电离程度增大,n(H+)增大,但c(H+)不断减小,故A错误;B、因电离平衡常数只与温度有关,则Ka(HF)在稀释过程中不变,故B错误;C、因稀释时一段时间电离产生等量的H+和F-,溶液的体积相同,则两种离子的浓度的比值不变,但随着稀释的不断进行,c(H+)不会超过10-7molL-1,c(F-)不断减小,则比值变小,故C错误;D、因Ka(HF)=![]() ,当HF溶液加水不断稀释,促进电离,c(F-)不断减小,Ka(HF)不变,则
,当HF溶液加水不断稀释,促进电离,c(F-)不断减小,Ka(HF)不变,则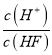 增大,故D正确;故选D。
增大,故D正确;故选D。

练习册系列答案
相关题目
【题目】为研究(NH4)2SO4和NH4HSO4混合物样品组成,称取四份该样品分别逐滴加入相同浓度的NaOH溶液25.0 mL,加热并完全反应,产生NH3的体积(NH3的体积已折算成标准状况,不考虑NH3在水中的溶解)如下表:
实验序号 | I | II | III | IV |
NaOH体积(mL) | 25.0 | 25.0 | 25.0 | 25.0 |
样品质量(g) | 3.62 | 5.43 | 7.24 | 10.86 |
NH3体积(mL) | 896 | 1344 | 1344 | 896 |
(1)样品中(NH4)2SO4和NH4HSO4的物质的量之比为 。
(2)NaOH溶液的物质的量浓度为 。
