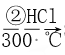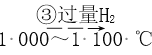题目内容
【题目】有A、B、C、D、E五种元素。
①A、B、C是金属元素,位于同一周期,原子核外都有3个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE, D的单质是黄绿色气体,常温下E的单质是液体。
请回答:
(1)B在周期表中的位置__________,C的原子结构示意图是__________。
(2)E单质的化学式是___________。
(3)上述五种元素中,所形成的最高价氧化物对应的水化物的酸性最强的物质是_____(化学式)。
(4)写出C的氧化物与A的最高价氧化物对应的水化物反应的离子方程式________
【答案】第3周期 ⅡA 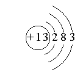 Br2 HClO4 Al2O3+2OH-=2AlO2-+H2O
Br2 HClO4 Al2O3+2OH-=2AlO2-+H2O
【解析】
A、B、C、D、E五种元素,由①知A、B、C均为第3周期的金属元素(只有Na、Mg、Al),A的原子半径在所属周期中最大,且原子半径A>B>C,则A为Na、B为Mg、C为Al;由②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,则D、E处于ⅦA族,D的单质是黄绿色气体,常温下E的单质是液体,则D为Cl、E为Br。
(1)B为Mg,在周期表中的位置:第3周期ⅡA族,C为Al,原子结构示意图是 ![]() ;
;
(2)E为Br元素,单质的化学式是Br2;
(3)上述五种元素中,非金属性最强的是Cl元素,则所形成的最高价氧化物对应的水化物的酸性最强的物质是HClO4;
(4)C的氧化物为Al2O3,A的最高价氧化物对应的水化物为NaOH,二者反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某学生为了探究锌与盐酸反应过程中的速率变化。在100 mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50.0 | 120.0 | 232.0 | 290.0 | 312.4 |
(1)解释2 min~3 min反应速率最大的原因______;反应速率最小的时间段是_____,原因为____。
(2)在4min~5 min时间段内,用盐酸的浓度变化表示的反应速率为____。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入下列溶液:
A. Na2CO3溶液 B.Na2SO4溶液 C.NaNO3溶液 D.少量CuSO4溶液
你认为不可行的是______。