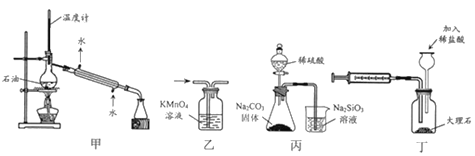
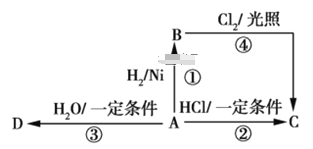
题目内容
【题目】20℃时,配制一组c(H2A)+ c(HA-)+ c(A2-)=0.100 mol·L-1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法正确的是
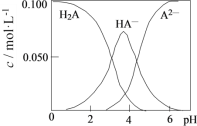
A. H2A在水中的电离方程式为:H2A=HA-+ H+,HA-![]() H++A2-
H++A2-
B. c(Na+)=0.100 mol·L-1的溶液中,c(H+)+c(H2A)=c(OH-)+ c(A2-)
C. pH=4的溶液中,c(HA-)>c(H2A)+ c(A2-)
D. pH=7的溶液中,c(Na+)=2c(A2-)
【答案】BC
【解析】
根据溶液中三个守恒关系分析解题。
A项:从图中看出,H2A、HA-、A2-的浓度都随着溶液pH的变化而改变。表明H2A为二元弱酸,电离方程式为:H2A![]() HA-+ H+,HA-
HA-+ H+,HA-![]() H++A2-。A项错误;
H++A2-。A项错误;
B项:当c(H2A)+ c(HA-)+ c(A2-)=c(Na+)=0.100 mol·L-1时,即为NaHA溶液,其质子守恒关系为c(H+)+c(H2A)=c(OH-)+ c(A2-)。B项正确;
C项:在图中pH=4的点作垂线,可知溶液中c(HA-) > 0.050mol·L-1,则(H2A)+ c(A2-) < 0.050mol·L-1。即c(HA-)>c(H2A)+ c(A2-)。C项正确;
D项:H2A和NaOH混合溶液中,电荷守恒c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-)。当溶液pH=7时,c(H+)=c(OH-),则c(Na+)=2c(A2-)+c(HA-)。D项错误。
本题选BC。

【题目】绿水青山就是金山银山,研究NO2, NO,CO,SO2 等大气污染物和温室效应的治理对建设美丽中国具有重要意义。
(1)已知:NO2(g)+CO(g) ![]() CO2(g)+NO(g) 该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2(g)+NO(g) 该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2, | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)═2NO(g)△H=+179.5kJmol1 k2
③2NO(g)+O2(g)═2NO2(g)△H=112.3kJmol1 k3
写出NO与CO反应生成无污染气体的热化学方程式为____________.该热化学方程式的平衡常数K为______________(用K1。K2。K3表示)。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:

①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)在体积可变的恒压密闭容器中充入1molCO2与足量的碳,让其发生反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

T℃时,若容器中充入惰性气体,v正 ______ v逆(填<,>,=),平衡______移动(填正向,逆向或不。下同),若充入等体积的CO2和CO,平衡_________移动。
650℃时,反应达平衡后CO2的转化率为________。