题目内容
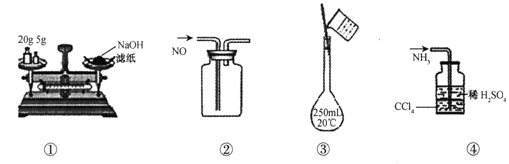
(13分)某含少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量。实验步骤如下:
①准确称量m g样品(2~3g);
②向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
③量取25mL操作②中配得的溶液,加入3 mL溴水,加热使Fe2+完全被氧化;
mL溴水,加热使Fe2+完全被氧化;
④趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤过滤,将沉淀洗涤、灼烧、冷却称量,反复操 作至恒重。
作至恒重。
请根据上面的叙述回答:
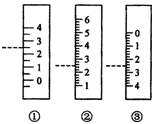
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质量 。
A.比m g多 B.比m g少 C.恰好为m g
(2)溶解样品时要加入盐酸,原因是 。
(3)配250mL溶液时,除需250mL容量瓶、烧杯外,还需用到的玻璃仪器是 、 。
(4)加入溴水时发生反应的离子方程式是 。
(5)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是 。
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净。当含有下列物质时,最终会使铁元素的测定含量:①NaCl ;②Fe2(SO4)3 (填“偏高”、“偏低”或“不变”)。
①准确称量m g样品(2~3g);
②向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
③量取25mL操作②中配得的溶液,加入3
 mL溴水,加热使Fe2+完全被氧化;
mL溴水,加热使Fe2+完全被氧化;④趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤过滤,将沉淀洗涤、灼烧、冷却称量,反复操
 作至恒重。
作至恒重。请根据上面的叙述回答:
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质量 。
A.比m g多 B.比m g少 C.恰好为m g
(2)溶解样品时要加入盐酸,原因是 。
(3)配250mL溶液时,除需250mL容量瓶、烧杯外,还需用到的玻璃仪器是 、 。
(4)加入溴水时发生反应的离子方程式是 。
(5)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是 。
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净。当含有下列物质时,最终会使铁元素的测定含量:①NaCl ;②Fe2(SO4)3 (填“偏高”、“偏低”或“不变”)。
(1)B (1分);
(2)抑制Fe2+、Fe3+的水解(2分);
(3)玻璃棒(1分)、胶头滴管(1分);
(4)2Fe2++Br2=2Fe3++2Br-(2分);
(5)7(W2-W1)/m(2分);
(6)①不变(2分)、 ②偏高(2分)。
②偏高(2分)。
(2)抑制Fe2+、Fe3+的水解(2分);
(3)玻璃棒(1分)、胶头滴管(1分);
(4)2Fe2++Br2=2Fe3++2Br-(2分);
(5)7(W2-W1)/m(2分);
(6)①不变(2分)、
 ②偏高(2分)。
②偏高(2分)。略

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目