题目内容
下列各图所示的实验原理、方法、装置或操作正确的是
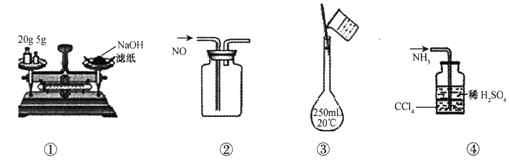

| A.①称量氢氧化钠固体 | B.②收集NO气体 |
| C.③配制100 mL 0.10 mol·L-1盐酸 | D.④吸收NH3时防止倒吸 |
D
略

练习册系列答案
相关题目
题目内容

| A.①称量氢氧化钠固体 | B.②收集NO气体 |
| C.③配制100 mL 0.10 mol·L-1盐酸 | D.④吸收NH3时防止倒吸 |
