题目内容
 如图是一块用FeCl3,溶液与Cu反应制作的印刷电路板,其制作原理可用下式表示:2FeCl3+Cu═CuCl2+2X.
如图是一块用FeCl3,溶液与Cu反应制作的印刷电路板,其制作原理可用下式表示:2FeCl3+Cu═CuCl2+2X.(1)上式中X物质的化学式为
(2)在上述反应中,氧化剂为
(3)用双线桥法表示该反应的电子转移情况:
(4)该反应的离子方程式为
分析:(1)根据原子守恒可确定X为何种物质;
(2)该反应的化学方程式为Cu+2FeCl3=CuCl2+2FeCl2,从化合价变化的角度判断氧化剂、还原剂、氧化产物和还原产物等概念;
(3)根据氧化还原反应中化合价的升降来分析电子转移情况;
(4)根据离子方程式的书写方法在Cu+2FeCl3=CuCl2+2FeCl2 基础上改写即可.
(2)该反应的化学方程式为Cu+2FeCl3=CuCl2+2FeCl2,从化合价变化的角度判断氧化剂、还原剂、氧化产物和还原产物等概念;
(3)根据氧化还原反应中化合价的升降来分析电子转移情况;
(4)根据离子方程式的书写方法在Cu+2FeCl3=CuCl2+2FeCl2 基础上改写即可.
解答:解:(1)根据原子守恒可知2X含有2个Fe,4个Cl,故X为FeCl2,
故答案为:FeCl2;
(2)反应中,FeCl3中Fe元素的化合价由+3价降低为+2价,FeCl3为氧化剂,被还原,对应的还原产物为FeCl2,Cu元素的化合价升高,由0价升高为+2价,为还原剂,被氧化物,对应的氧化产物为CuCl2;根据氧化剂的氧化性大于氧化产物的氧化性,可得氧化性:FeCl3>CuCl2,
故答案为:FeCl3;CuCl2;FeCl3;
(3)反应Cu+2FeCl3═CuCl2+2FeCl2中,化合价升高元素是铜,化合价降低的元素是铁,转移电子数为2,
故答案为: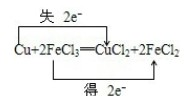 ;
;
(4)FeCl3、CuCl2、FeCl2均易溶易电离拆成离子形式,删除不反应的离子即得Cu+2Fe3+═Cu2++2Fe2+,
故答案为:Cu+2Fe3+═Cu2++2Fe2+.
故答案为:FeCl2;
(2)反应中,FeCl3中Fe元素的化合价由+3价降低为+2价,FeCl3为氧化剂,被还原,对应的还原产物为FeCl2,Cu元素的化合价升高,由0价升高为+2价,为还原剂,被氧化物,对应的氧化产物为CuCl2;根据氧化剂的氧化性大于氧化产物的氧化性,可得氧化性:FeCl3>CuCl2,
故答案为:FeCl3;CuCl2;FeCl3;
(3)反应Cu+2FeCl3═CuCl2+2FeCl2中,化合价升高元素是铜,化合价降低的元素是铁,转移电子数为2,
故答案为:
 ;
;(4)FeCl3、CuCl2、FeCl2均易溶易电离拆成离子形式,删除不反应的离子即得Cu+2Fe3+═Cu2++2Fe2+,
故答案为:Cu+2Fe3+═Cu2++2Fe2+.
点评:本题考查铁离子的氧化性,涉及氧化还原反应原理较多,离子方程式的书写要遵循写-拆-删-查步骤,重点在拆分,整体难度适中.

练习册系列答案
相关题目
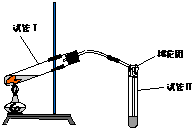 如图是实验室用铜片与浓硫酸制取SO2并验证其性质的装置图.往试管Ⅰ中加入一小块铜片,再加入3~5mL 浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管Ⅱ的溶液中.
如图是实验室用铜片与浓硫酸制取SO2并验证其性质的装置图.往试管Ⅰ中加入一小块铜片,再加入3~5mL 浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管Ⅱ的溶液中.

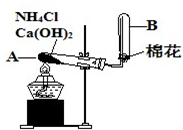 如图是实验室用氯化铵和熟石灰制取氨气的实验装置图.请回答以下各问题:
如图是实验室用氯化铵和熟石灰制取氨气的实验装置图.请回答以下各问题: