题目内容
如图是实验室用乙醇与浓硫酸制取并检验乙烯性质实验的装置图.
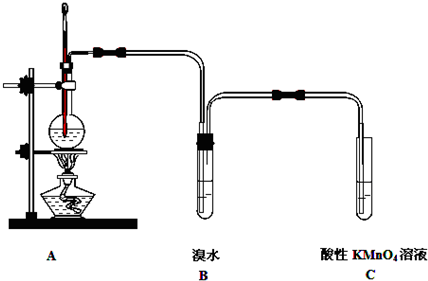
(1)写出制取乙烯的化学方程式:
(2)该反应中浓硫酸所起的作用是
(3)在圆底烧瓶中放入几块碎瓷片的目的是
(4)当乙烯通过C装置时,观察到溶液的颜色
(5)如某学生用该装置进行实验时,没有观察到B装置中橙红色的溴水褪色,分析产生这一现象的可能原因是
a.乙烯未经过干燥
b.乙烯不能跟溴水反应
c.乙烯跟溴水反应的产物也呈橙红色
d.反应温度过低,没有乙烯生成.

(1)写出制取乙烯的化学方程式:
CH3CH2OH
CH2=CH2↑+H2O
| 浓硫酸 |
| 170°C |
CH3CH2OH
CH2=CH2↑+H2O
.| 浓硫酸 |
| 170°C |
(2)该反应中浓硫酸所起的作用是
催化剂
催化剂
和脱水剂
脱水剂
.(3)在圆底烧瓶中放入几块碎瓷片的目的是
防止暴沸
防止暴沸
.(4)当乙烯通过C装置时,观察到溶液的颜色
溶液的紫色褪去
溶液的紫色褪去
.(5)如某学生用该装置进行实验时,没有观察到B装置中橙红色的溴水褪色,分析产生这一现象的可能原因是
d
d
(填标号).a.乙烯未经过干燥
b.乙烯不能跟溴水反应
c.乙烯跟溴水反应的产物也呈橙红色
d.反应温度过低,没有乙烯生成.
分析:(1)实验室利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯;
(2)浓硫酸作催化剂、脱水剂;
(3)反应条件是加热到170℃,因乙醇的沸点低,易暴沸,所以加沸石;
(4)乙烯使酸性高锰酸钾溶液褪色,是高锰酸钾和乙烯发生了氧化反应;
(5)乙醇与浓硫酸共热至140℃会生成乙醚,乙醚不能使橙红色的溴水褪色.
(2)浓硫酸作催化剂、脱水剂;
(3)反应条件是加热到170℃,因乙醇的沸点低,易暴沸,所以加沸石;
(4)乙烯使酸性高锰酸钾溶液褪色,是高锰酸钾和乙烯发生了氧化反应;
(5)乙醇与浓硫酸共热至140℃会生成乙醚,乙醚不能使橙红色的溴水褪色.
解答:解:(1)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生消去反应,所以实验室制取乙烯的化学方程式为:CH3CH2OH
CH2=CH2↑+H2O,
故答案为:CH3CH2OH
CH2=CH2↑+H2O;
(2)浓硫酸具有脱水性,乙醇在一定的条件下生成乙烯,乙醇分子内脱水,所以该反应中浓硫酸具有催化性和脱水性,
故答案为:催化剂;脱水剂;
(3)反应条件是加热到170℃,因乙醇的沸点低,易暴沸,在圆底烧瓶中放入几块碎瓷片的目的是防止暴沸,故答案为:防止暴沸;
(4)乙烯分子中含有碳碳双键,能够被高锰酸钾溶液氧化,导致高锰酸钾溶液褪色,
故答案为:溶液的紫色褪去;
(5)a.溴水中本身含有水,乙烯未经过干燥无影响,故a错误;
b.乙烯能跟溴水发生加成反应CH2=CH2+Br2→CH2Br-CH2Br,故b错误;
c.乙烯跟溴水反应的产物CH2Br-CH2Br呈无色,故c错误;
d.反应温度过低,生成乙醚没有乙烯生成,故d正确;
故选d;
| 浓硫酸 |
| 170°C |
故答案为:CH3CH2OH
| 浓硫酸 |
| 170°C |
(2)浓硫酸具有脱水性,乙醇在一定的条件下生成乙烯,乙醇分子内脱水,所以该反应中浓硫酸具有催化性和脱水性,
故答案为:催化剂;脱水剂;
(3)反应条件是加热到170℃,因乙醇的沸点低,易暴沸,在圆底烧瓶中放入几块碎瓷片的目的是防止暴沸,故答案为:防止暴沸;
(4)乙烯分子中含有碳碳双键,能够被高锰酸钾溶液氧化,导致高锰酸钾溶液褪色,
故答案为:溶液的紫色褪去;
(5)a.溴水中本身含有水,乙烯未经过干燥无影响,故a错误;
b.乙烯能跟溴水发生加成反应CH2=CH2+Br2→CH2Br-CH2Br,故b错误;
c.乙烯跟溴水反应的产物CH2Br-CH2Br呈无色,故c错误;
d.反应温度过低,生成乙醚没有乙烯生成,故d正确;
故选d;
点评:本题考查了乙烯的实验室制法并检验乙烯性质,掌握反应的原理和掌握乙烯的化学性质是解答本题的关键,题目较简单.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目


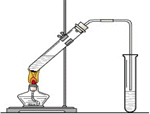 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题
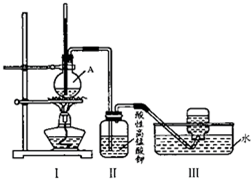 某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.
某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.