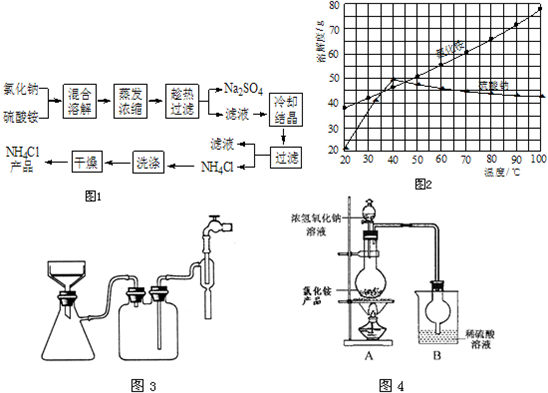
题目内容
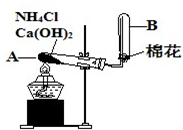 如图是实验室用氯化铵和熟石灰制取氨气的实验装置图.请回答以下各问题:
如图是实验室用氯化铵和熟石灰制取氨气的实验装置图.请回答以下各问题:(1)写出制取氨气的化学方程式
(2)试管A的管口必须稍向下倾斜,其作用是
(3)试管B必须干燥的原因是
(4)检验氨气已充满试管B的方法是
(5)如制得标准状况下的氨气2.24L,则反应中至少需要熟石灰
分析:(1)实验室制备氨气的方法是利用固体氯化铵和氢氧化钙加热反应生成氨气;
(2)固体在大试管中加热会生成水,试管A的管口必须稍向下倾斜,防止水倒流;
(3)氨气是极易溶于水的气体,收集时试管必须干燥;
(4)氨气能使湿润的红色石蕊试纸变蓝色进行验证;
(5)依据化学方程式定量关系计算得到.
(2)固体在大试管中加热会生成水,试管A的管口必须稍向下倾斜,防止水倒流;
(3)氨气是极易溶于水的气体,收集时试管必须干燥;
(4)氨气能使湿润的红色石蕊试纸变蓝色进行验证;
(5)依据化学方程式定量关系计算得到.
解答:解:(1)实验室制备氨气的方法是利用固体氯化铵和氢氧化钙加热反应生成氨气,反应的化学方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)试管A的管口必须稍向下倾斜,其作用是防止反应过程中生成的水倒流回试管炸裂试管,
故答案为:防止反应过程中生成的水倒流回试管炸裂试管;
(3)氨气是极易溶于水的气体,收集时试管必须干燥,否则收集不到氨气,
故答案为:氨气是极易溶于水的气体;
(4)检验氨气已充满试管B的方法是用湿润的红色石蕊试纸靠近B试管口,试纸变蓝证明集满,
故答案为:用湿润的红色石蕊试纸靠近B试管口,试纸变蓝证明集满;
(5)如制得标准状况下的氨气2.24L,物质的量为0.1mol,依据化学方程式定量关系得到需要氢氧化钙物质的量为0.05mol,质量=0.05mol×74g/mol=3.7g,
故答案为:3.7.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)试管A的管口必须稍向下倾斜,其作用是防止反应过程中生成的水倒流回试管炸裂试管,
故答案为:防止反应过程中生成的水倒流回试管炸裂试管;
(3)氨气是极易溶于水的气体,收集时试管必须干燥,否则收集不到氨气,
故答案为:氨气是极易溶于水的气体;
(4)检验氨气已充满试管B的方法是用湿润的红色石蕊试纸靠近B试管口,试纸变蓝证明集满,
故答案为:用湿润的红色石蕊试纸靠近B试管口,试纸变蓝证明集满;
(5)如制得标准状况下的氨气2.24L,物质的量为0.1mol,依据化学方程式定量关系得到需要氢氧化钙物质的量为0.05mol,质量=0.05mol×74g/mol=3.7g,
故答案为:3.7.
点评:本题考查了实验室制备氨气的实验过程分析,实验基本操作和物质性质是解题关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 如图是实验室制取氨气的气体发生装置,请
如图是实验室制取氨气的气体发生装置,请