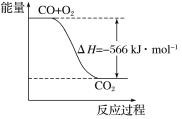
题目内容
【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为_________;
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2 形式存在的。使氢氟酸分子缔合的作用力是________;
(3)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图 I、 II 所示:
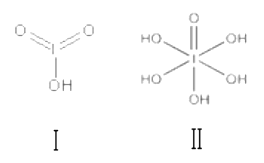
请比较二者酸性强弱: HIO3_____ (填“>”、“<”或“=”)H5IO6;
(4)已知 ClO2- 为 V 形结构,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体_________;
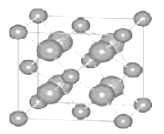
(5)如图为碘晶体晶胞结构。有关说法中正确的是_____________。
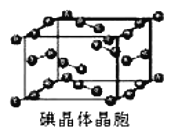
A.碘分子排列有2 种不同取向,2 种取向不同的碘分子以4 配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有 4 个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(6)已知 CaF2 晶体(如图)的密度为 ρg/cm3, NA为阿伏加德罗常数,棱上相邻的两个 Ca2+的核间距为 a cm,则CaF2 的相对分子质量可以表示为___________。
【答案】 p 4s24p5 氢键 > sp3 Cl2O或OF2 AD ![]()
【解析】(1)根据基态原子核外电子排布式中最后填入电子名称确定区域名称,卤族元素最后填入的电子为p电子,所以卤族元素位于元素周期表的p区;溴是35号元素,最外层电子为其价电子,4s能级上有2个电子,4p能级上有5个电子,所以其价电子排布式为:4s24p5。
(2)F元素的非金属性很强,HF分子间能形成氢键,所以在二分子缔合(HF)2中使氢氟酸分子缔合的作用力是氢键。
(3)由碘酸与高碘酸的结构图可得,碘酸分子中含有2个非羟基氧,高碘酸中含有1个非羟基氧,根据含氧酸中含非羟基氧原子个数越多酸性越强,则酸性:碘酸(HIO3)>高碘酸(H5IO6)。
(4)根据价层电子对互斥理论确定杂化方式,价层电子对个数=σ键个数+孤电子对个数,ClO2-中心氯原子的价层电子对数n=2+![]() =4,则属于sp3杂化;等电子体是具有相同的电子数和原子数的微粒,所以与ClO2-互为等电子体的分子为Cl2O、OF2等。
=4,则属于sp3杂化;等电子体是具有相同的电子数和原子数的微粒,所以与ClO2-互为等电子体的分子为Cl2O、OF2等。
(5)A项,碘分子的排列有在顶点和面心2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构,故A正确;B项,用均摊法可知平均每个晶胞中碘分子个数为:8×![]() +6×
+6×![]() =4,即有8个碘原子,故B错误;C项,碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,故C错误;D项,碘晶体中的碘原子间存在I-I非极性键,且晶体中分子之间存在范德华力,故D正确;综上,选AD。
=4,即有8个碘原子,故B错误;C项,碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,故C错误;D项,碘晶体中的碘原子间存在I-I非极性键,且晶体中分子之间存在范德华力,故D正确;综上,选AD。
(6)该立方体中钙离子位于顶点,数目为:8×![]() +6×
+6×![]() =4,氟离子位于内部,数目为8,设CaF2的摩尔质量为M,则晶胞摩尔质量为4M,因为棱上相邻两个Ca2+的核间距为acm,则晶胞边长为acm,所以ρa3=
=4,氟离子位于内部,数目为8,设CaF2的摩尔质量为M,则晶胞摩尔质量为4M,因为棱上相邻两个Ca2+的核间距为acm,则晶胞边长为acm,所以ρa3=![]() ,解得:M=
,解得:M=![]() 。
。

【题目】下列各组物质中,能一步实现下图所示①~⑤转化关系的是
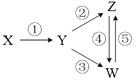
X | Y | Z | W | |
A | C | CO | CO2 | Na2CO3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. A B. B C. C D. D