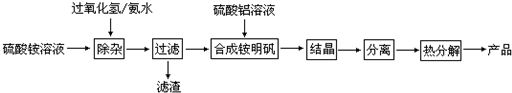
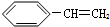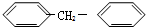题目内容
4.一定温度下,向一个容积为2L的真空密闭容器中(事先装入催化剂)通入1mol N2和3mol H2,发生下列反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3.3min后测得密闭容器内的压强是起始时的0.9倍,在此时间内v(H2)是( )| A. | 0.2 mol/(L•min) | B. | 0.6 mol/(L•min) | C. | 0.1 mol/(L•min) | D. | 0.3 mol/(L•min) |
分析 利用压强之比等于物质的量之比,求出3min末时容器内混合气体的物质的量,根据方程式利用差量法计算氢气的物质的量变化量,再利用根据v=$\frac{△c}{△t}$计算v(H2).
解答 解:3min末测得容器内压强是起始时压强的0.9倍,压强之比等于物质的量之比,
所以3min末时容器内混合气体的物质的量为(1mol+3mol)×0.9=3.6mol
3H2+N2 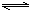 2NH3 物质的量变化△n
2NH3 物质的量变化△n
3 2
△n(H2) 4mol-3.6mol=0.4mol
所以△n(H2)=$\frac{3}{2}$×0.4mol=0.6mol,
所以3min内,用H2表示的平均反应速率v(H2)=$\frac{\frac{0.6mol}{2L}}{3min}$=0.1mol/(L•min),
故选:C.
点评 本题考查反应速率的有关计算,难度不大,关键根据压强变化计算参加反应的氢气的物质的量,注意差量法的应用.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
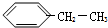
1.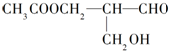 在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质,它就一定具有光学活性,某物质如图,具有光学活性,发生下列哪个反应后生成的有机物无光学活性( )
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质,它就一定具有光学活性,某物质如图,具有光学活性,发生下列哪个反应后生成的有机物无光学活性( )
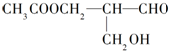 在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质,它就一定具有光学活性,某物质如图,具有光学活性,发生下列哪个反应后生成的有机物无光学活性( )
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质,它就一定具有光学活性,某物质如图,具有光学活性,发生下列哪个反应后生成的有机物无光学活性( )| A. | 与甲酸发生酯化反应 | B. | 与NaOH溶液共热 | ||
| C. | 与银氨溶液作用 | D. | 与浓溴水作用 |
2.下列粒子的结构示意图中,表示氯离子的是( )
| A. | 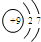 | B. | 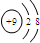 | C. | 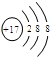 | D. |  |
9.下列实验现象与对应化学方程式都正确的是( )
| A. | 金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;Na+H2O═NaOH+H2↑ | |
| B. | 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2═2HCl | |
| C. | FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色; 2Fe(OH)2+O2+H2O═2 Fe(OH)3 | |
| D. | 向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有透明的硅酸凝胶产生;Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl |
16.有关高温结构陶瓷和光导纤维说法不正确的是( )
| A. | 光导纤维是一种能高质量传导光的玻璃纤维 | |
| B. | 光导纤维的抗干扰性能好,不发生电辐射,通讯质量高,能防窃听 | |
| C. | 高温结构陶瓷弥补了金属材料的弱点,但是硬度却远远低于金属材料 | |
| D. | 氮化硅陶瓷是一种重要的结构材料,具有超硬性,它能与氢氟酸反应 |
13.保护环境是每一个公民的责任,下列做法不利于保护环境的是( )
| A. | 城市垃圾分类处理 | B. | 推广使用清洁能源 | ||
| C. | 过量使用化肥、农药 | D. | 推广使用无氟冰箱 |