题目内容
(2013?江苏三模)某研究小组利用工业生产钛白粉产生的废液(含有大量的Fe2+、H+、S和少量的Fe3+、TiO2+)生产乳酸亚铁,其工艺流程如图所示:
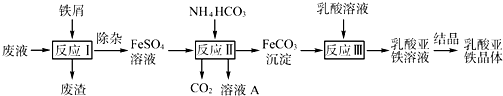
(1)反应Ⅰ中,铁屑与TiO2+反应的离子方程式为2TiO2++Fe+4H+?2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K=
.
(2)反应Ⅱ需控制反应温度低于35℃,其目的是
(3)已知:FeCO3(s)?Fe2+(aq)+C(aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因:
(4)结晶过程必须控制在一定的真空度条件下进行,原因是:

(1)反应Ⅰ中,铁屑与TiO2+反应的离子方程式为2TiO2++Fe+4H+?2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K=
| c(Ti3+)2?c(Fe2+)2 |
| c(TiO2+)2?c(H+)4 |
| c(Ti3+)2?c(Fe2+)2 |
| c(TiO2+)2?c(H+)4 |
(2)反应Ⅱ需控制反应温度低于35℃,其目的是
防止NH4HCO3分解(或减少Fe2+的水解)
防止NH4HCO3分解(或减少Fe2+的水解)
,该反应的化学方程式是FeSO4+2NH4HCO3═FeCO3↓+H2O+CO2↑+(NH4)2SO4
FeSO4+2NH4HCO3═FeCO3↓+H2O+CO2↑+(NH4)2SO4
.检验溶液A中是否含Fe2+的实验操作方法是取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水,溶液呈血红色,证明有Fe2+;反之,不含有Fe2+
取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水,溶液呈血红色,证明有Fe2+;反之,不含有Fe2+
.(3)已知:FeCO3(s)?Fe2+(aq)+C(aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因:
C与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁
C与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁
.(4)结晶过程必须控制在一定的真空度条件下进行,原因是:
有利于水的蒸发
有利于水的蒸发
、防止Fe2+被氧化
防止Fe2+被氧化
.分析:(1)反应物铁和生成物水在反应平衡常数中不写,该反应的平衡常数表达式是K=
;
(2)碳酸氢铵热稳定性差,反应温度不宜太高;碳酸氢铵和硫酸亚铁反应生成了碳酸铁、二氧化碳和水;亚铁离子的检验方法;
(3)根据勒夏特列原理解释,乳酸和C反应,平衡向着使C增加的方向移动,即正向移动;
(4)结晶过程必须控制在一定的真空度条件下进行,有利于水的蒸发,且防止Fe2+被氧化.
| c(Ti3+)2?c(Fe2+)2 |
| c(TiO2+)2?c(H+)4 |
(2)碳酸氢铵热稳定性差,反应温度不宜太高;碳酸氢铵和硫酸亚铁反应生成了碳酸铁、二氧化碳和水;亚铁离子的检验方法;
(3)根据勒夏特列原理解释,乳酸和C反应,平衡向着使C增加的方向移动,即正向移动;
(4)结晶过程必须控制在一定的真空度条件下进行,有利于水的蒸发,且防止Fe2+被氧化.
解答:解:(1)根据化学平衡常数表达式,可以写出该反应的平衡常数表达式为:K=
,故答案为:
;
(2)反应Ⅱ需控制反应温度低于35℃,其目的是防止NH4HCO3分解(或减少Fe2+的水解);该反应中,反应物是硫酸亚铁和碳酸氢铵,生成物是碳酸铁、二氧化碳,配平方程式为:FeSO4+2NH4HCO3═FeCO3↓+H2O+CO2↑+(NH4)2SO4;检验亚铁离子的方法是:取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水,溶液呈血红色,证明有Fe2+;反之,不含有Fe2+
故答案为:防止NH4HCO3分解(或减少Fe2+的水解);FeSO4+2NH4HCO3═FeCO3↓+H2O+CO2↑+(NH4)2SO4;取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水,溶液呈血红色,证明有Fe2+;反之,不含有Fe2+;
(3)根据平衡移动原理,C与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁;
故答案为:C与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁;
(4)由于在真空度条件下,可以防止亚铁离子氧化,有利于水分的蒸发,故答案为:有利于水的蒸发 防止Fe2+被氧化.
| c(Ti3+)2?c(Fe2+)2 |
| c(TiO2+)2?c(H+)4 |
| c(Ti3+)2?c(Fe2+)2 |
| c(TiO2+)2?c(H+)4 |
(2)反应Ⅱ需控制反应温度低于35℃,其目的是防止NH4HCO3分解(或减少Fe2+的水解);该反应中,反应物是硫酸亚铁和碳酸氢铵,生成物是碳酸铁、二氧化碳,配平方程式为:FeSO4+2NH4HCO3═FeCO3↓+H2O+CO2↑+(NH4)2SO4;检验亚铁离子的方法是:取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水,溶液呈血红色,证明有Fe2+;反之,不含有Fe2+
故答案为:防止NH4HCO3分解(或减少Fe2+的水解);FeSO4+2NH4HCO3═FeCO3↓+H2O+CO2↑+(NH4)2SO4;取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水,溶液呈血红色,证明有Fe2+;反之,不含有Fe2+;
(3)根据平衡移动原理,C与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁;
故答案为:C与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁;
(4)由于在真空度条件下,可以防止亚铁离子氧化,有利于水分的蒸发,故答案为:有利于水的蒸发 防止Fe2+被氧化.
点评:本题考查了乳酸亚铁晶体的制取,涉及了化学平衡常数书写、化学平衡原理的应用等知识,关键是认真分析题中信息,根据所学知识合理处理,本题难度稍大.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
 (2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下:
(2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下: