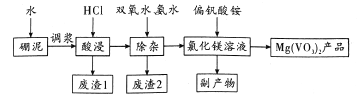
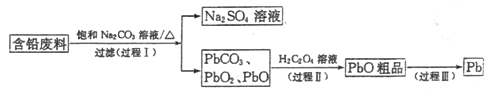
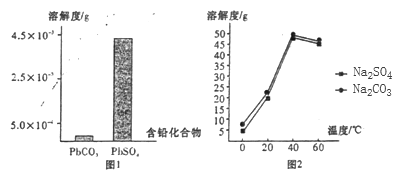
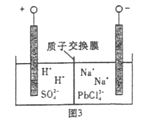
题目内容
【题目】常温下,向20ml某浓度的硫酸溶液中滴入0.1mol.l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是

A.V=40
B.C点所示溶液中:c(H+)-c(OH-)=2c(NH3.H2O)
C.d点所示溶液中:c(NH4+)=2c(SO42-)
D.NH3.H2O的电离常数K=10-4
【答案】C
【解析】
试题分析:A、a点溶液是硫酸,根据由水电离出的氢离子浓度可知溶液中c(OH-)=10-13 mol/L ,则溶液中c(H+)=0.1mol/L ,c(H2SO4) =0.05 mol/L 。随着氨水的滴入,溶液酸性减弱,对水的电离的抑制减弱,水电离出的c(H+) 增大,当由水电离出的c(H+) 达到最大值时,就是(NH4)2SO4 的量最多时,也就是酸碱滴定的终点,所以c 点就是酸碱恰好反应的点,所以V=20ml,A错误;B、c 点就是酸碱恰好反应的点,溶液中的溶质是(NH4)2SO4 ,根据电荷守恒c(H+) +c(NH4+)= 2c(SO42-)+ c(OH-),物料守恒c(NH3.H2O) +c(NH4+)= 2c(SO42-),所以c(H+)-c(OH-)=c(NH3.H2O),B错误;C、c点往后,氨水开始过量,氨水对水的电离又起抑制作用,由水电离出的c(H+) 又开始下降。到d 点时,溶液中由水电离出的氢离子浓度与纯水中由水电离出的氢离子浓度相等,此时溶液中(NH4)2SO4 的水解和NH3.H2O 的电离互相抑制,使溶液显中性,根据电荷守恒得c(NH4+)=2c(SO42-),C正确;D、c 点时溶液中的溶质是(NH4)2SO4 ,只发生NH4+的水解,由图中数据可知NH4+的水解常数Kh= c(NH3.H2O) c(H+)/ c(NH4+)=(5×10-6)2/0.1=2.5×10-10,NH3.H2O的电离常数K= c(NH4+) c(OH-)/ c(NH3.H2O),K×Kh=Kw=10-14,则K=0.4×10-4,D错误。答案选C。

 阅读快车系列答案
阅读快车系列答案