题目内容
工业上利用下列反应进行海水中溴元素的富集:Br2+SO2+2H2O=H2SO4+2HBr.在该反应中,氧化剂是________(填化学式);若反应中生成了 0.2mol HBr,则消耗SO2的体积(标准状况)是________.
Br2 2.24L
分析:Br2+SO2+2H2O=H2SO4+2HBr中,Br元素的化合价由0降低为-1价,S元素的化合价由+4升高为+6价,由反应可知,生成2molHBr消耗1molSO2,以此解答.
解答:Br2+SO2+2H2O=H2SO4+2HBr中,Br元素的化合价由0降低为-1价,S元素的化合价由+4升高为+6价,则氧化剂为Br2,
由反应可知,生成2molHBr消耗1molSO2,则生成了0.2mol HBr,则消耗SO2的体积为0.1mol×22.4L/mol=2.24L,
故答案为:Br2;2.24L.
点评:本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,注重基础知识的考查,题目难度不大.
分析:Br2+SO2+2H2O=H2SO4+2HBr中,Br元素的化合价由0降低为-1价,S元素的化合价由+4升高为+6价,由反应可知,生成2molHBr消耗1molSO2,以此解答.
解答:Br2+SO2+2H2O=H2SO4+2HBr中,Br元素的化合价由0降低为-1价,S元素的化合价由+4升高为+6价,则氧化剂为Br2,
由反应可知,生成2molHBr消耗1molSO2,则生成了0.2mol HBr,则消耗SO2的体积为0.1mol×22.4L/mol=2.24L,
故答案为:Br2;2.24L.
点评:本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目

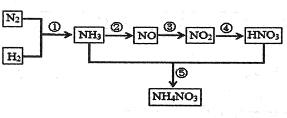
 2NO2(g)在前1l0s内的反应进
2NO2(g)在前1l0s内的反应进
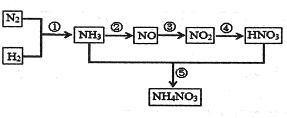
 2NO2(g)在前1l0s内的反应进
2NO2(g)在前1l0s内的反应进

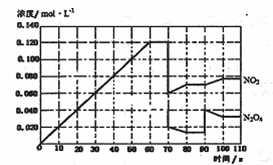

 2NO2(g)在前1l0s内的反应进
2NO2(g)在前1l0s内的反应进