题目内容
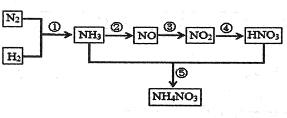
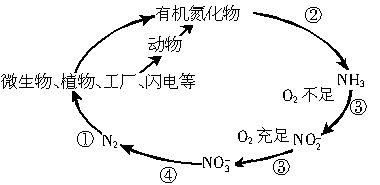
自然界中氮的循环涉及到地球上生物圈的方方面面.人类进入工业化社会以后,化学合成氮肥的数量迅速上升,对氮的循环和环境影响很大.下图是工业合成氮肥的转化关系:
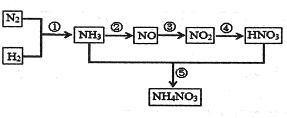
回答下列问题:
(1)反应①的条件是______,反应④的化学方程式为______,反应⑤所得产物的溶液中离子浓度由大到小得顾序为______.
(2)实验室制取NH3的一种方法是在生石灰中滴加浓氨水,其原因是______.
(3)硝酸厂的尾气含有氮的氧化物,直接排放将污染空气.目前科学家探索利用燃料气体中的CH4等将氮的氧化物还原为N2和H2O,反应原理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO2(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则CH4直接将NO2还原为N2的热化学方程式为______.
(4)下图表示某温度时,反应N2O4(g)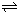 2NO2(g)在前1l0s内的反应进
2NO2(g)在前1l0s内的反应进

①此反应的平衡常数表达式K=______.
②反应进行到70s时,改变的条件可能是______(填字母),反应进行到90s时,改变的条件可能是______(填字母)
A.加入催化剂 B.扩大容器体积 C.升高温度 D.增大N2O4的浓度
③请在图中画出反应物N2O4在0~70秒时的浓度变化曲线.
解:(1)氮气和氢气需在高温、高压、催化剂的条件下合成氨气;二氧化氮能和水反应生成硝酸和一氧化氮;硝酸铵的水溶液中,铵根离子易水解,溶液显酸性,所以
C(NO3-)>C(NH4+)>C(H+)>C(OH-),故答案为:高温、高压、催化剂;3NO2+H2O═2HNO3+NO;C(NO3-)>C(NH4+)>C(H+)>C(OH-);
(2)氧化钙与氨水中的反应生氢氧化钙,反应放热,氢氧化钙为强碱,并且氨水中存在平衡:NH3+H2O?NH3?H20?NH4++OH-,氢氧化钙的生成所释放的热以及氢氧根的生成均能使
平衡向生成氨气的方向移动,所以在生石灰中滴加浓氨水,可以产氨气,故答案为:氧化钙与氨水中的反应生氢氧化钙,使氨水的浓度氢氧根浓度均增大,同时溶液温度升高,
共同导致平衡NH3+H2O?NH3?H20?NH4++OH-向左移生成氨气;
(3)根据盖斯定律,其热化学方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1;
(4)①平衡常数等于产物的平衡浓度系数次方的乘积与各个反应物平衡浓度系数次方乘积的比值,根据反应N2O4(g)?2NO2(g),即K=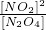 ,故答案为:
,故答案为: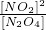 ;
;
②影响化学平衡移动的因素有:温度、浓度、压强等,在70s时,二氧化氮的浓度迅速降低,所以可以是扩大容器体积,在90s时,四氧化二氮的浓度迅速升高,可以是增加
了N2O4的浓度,故答案为:B;D;
③根据反应N2O4(g)?2NO2(g)可知,相同时间内四氧化二氮和二氧化氮浓度的变化量之比等于1:2,据此来作图得:

故答案为: .
.
分析:(1)氮气和氢气需在高温、高压、催化剂的条件下合成氨气;二氧化氮能和水反应生成硝酸和一氧化氮;硝酸铵的水溶液显酸性;
(2)氨水中存在平衡:NH3+H2O?NH3?H20?NH4++OH-,在生石灰中滴加浓氨水,可以产氨气;
(3)根据盖斯定律可以计算CH4直接将NO2还原为N2的焓变,进而写出其热化学方程式;
(4)平衡常数等于产物的平衡浓度系数次方的乘积与各个反应物平衡浓度系数次方乘积的比值;影响化学平衡移动的因素有:温度、浓度、压强等;根据反应N2O4(g)?2NO2(g)可知,四氧化二氮和二氧化氮浓度的变化量之比等于1:2,据此来作图.
点评:本题是一道有关含氮化合物知识的大型综合题,考察角度很广,难度较大.
C(NO3-)>C(NH4+)>C(H+)>C(OH-),故答案为:高温、高压、催化剂;3NO2+H2O═2HNO3+NO;C(NO3-)>C(NH4+)>C(H+)>C(OH-);
(2)氧化钙与氨水中的反应生氢氧化钙,反应放热,氢氧化钙为强碱,并且氨水中存在平衡:NH3+H2O?NH3?H20?NH4++OH-,氢氧化钙的生成所释放的热以及氢氧根的生成均能使
平衡向生成氨气的方向移动,所以在生石灰中滴加浓氨水,可以产氨气,故答案为:氧化钙与氨水中的反应生氢氧化钙,使氨水的浓度氢氧根浓度均增大,同时溶液温度升高,
共同导致平衡NH3+H2O?NH3?H20?NH4++OH-向左移生成氨气;
(3)根据盖斯定律,其热化学方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1;
(4)①平衡常数等于产物的平衡浓度系数次方的乘积与各个反应物平衡浓度系数次方乘积的比值,根据反应N2O4(g)?2NO2(g),即K=
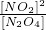 ,故答案为:
,故答案为: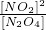 ;
;②影响化学平衡移动的因素有:温度、浓度、压强等,在70s时,二氧化氮的浓度迅速降低,所以可以是扩大容器体积,在90s时,四氧化二氮的浓度迅速升高,可以是增加
了N2O4的浓度,故答案为:B;D;
③根据反应N2O4(g)?2NO2(g)可知,相同时间内四氧化二氮和二氧化氮浓度的变化量之比等于1:2,据此来作图得:

故答案为:
 .
.分析:(1)氮气和氢气需在高温、高压、催化剂的条件下合成氨气;二氧化氮能和水反应生成硝酸和一氧化氮;硝酸铵的水溶液显酸性;
(2)氨水中存在平衡:NH3+H2O?NH3?H20?NH4++OH-,在生石灰中滴加浓氨水,可以产氨气;
(3)根据盖斯定律可以计算CH4直接将NO2还原为N2的焓变,进而写出其热化学方程式;
(4)平衡常数等于产物的平衡浓度系数次方的乘积与各个反应物平衡浓度系数次方乘积的比值;影响化学平衡移动的因素有:温度、浓度、压强等;根据反应N2O4(g)?2NO2(g)可知,四氧化二氮和二氧化氮浓度的变化量之比等于1:2,据此来作图.
点评:本题是一道有关含氮化合物知识的大型综合题,考察角度很广,难度较大.

练习册系列答案
相关题目
 2NO2(g)在前1l0s内的反应进
2NO2(g)在前1l0s内的反应进

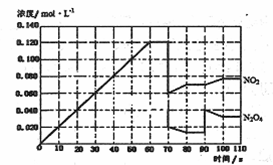

 2NO2(g)在前1l0s内的反应进
2NO2(g)在前1l0s内的反应进